
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
科目:高中化学 来源: 题型:实验题
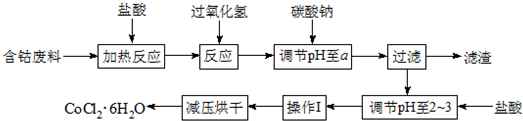
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧具有氧化性,可用作自来水的消毒剂 | |
| B. | 活性炭具有还原性,可用作制糖业脱色剂 | |
| C. | 氢氟酸具有弱酸性,可用作玻璃的蚀刻剂 | |
| D. | 氨气具有弱碱性,可用作食品工业制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将22.4LHCl溶于1L水,可配成1mol•L-l的稀盐酸 | |
| B. | 将100mL18mol•L-1的浓H2SO4和100mL水混合,可配成9moI•L-l的H2SO4溶液 | |
| C. | 将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,配成1mol•L-1的NaOH溶液 | |
| D. | 将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
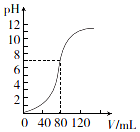 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com