
【题目】在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
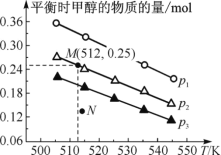
A. 该反应的正反应为放热反应
B. 压强大小关系:p1<p2<p3
C. M点对应的平衡常数K的值约为 1.04×10-2
D. 在p2及512 K时,图中N点v(正)<v(逆)
【答案】AC
【解析】
A. 由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,A项正确;
B. 由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,B项错误;
C. 由图可知,M点对应的甲醇产量为0.25mol,则
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 12.75 0 0
转化量(mol) 0.250.75 0.25 0.25
平衡量(mol) 0.75 2 0.250.25
又体积为1.0L,所以K=![]() = 1.04×102,C项正确;
= 1.04×102,C项正确;
D. 由图可知,在p2及512K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),D项错误;
答案选AC。


科目:高中化学 来源: 题型:
【题目】铬及其化合物在工农业生产中具有广泛应用,请回答下列问题:
(1)基态铬原子的核外电子排布式为_____________。
(2)Cr3+能形成配离子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配体H2NCH2CH2NH2 中采用 sp3杂化的原子有_____。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与 CS2 等互溶.则固态 CrO2Cl2属于________晶体。已知 NO2+与 CS2 互为等电子体,则 1molNO2+中含有π键数目为 ____________
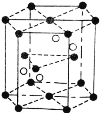
(4)Cr2O3 晶胞结构如图所示,已知 Cr2O3 的摩尔质量为 M g/mol,晶体的密度为ρ g·cm-3 ,晶胞体积为 V cm3. 晶胞结构示意图中的小黑球代表_____(填“铬离子”或“氧离子”),阿伏加德罗常数NA=_________mol-1(用含 M, V, ρ的代数式表示 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
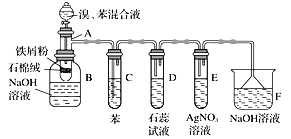
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯,发生反应。写出A中所发生反应的化学方程式:___________________________________________________________。
(2)试管观察D中看到的现象为____________________________________。
(3)在上述整套装置中,具有防倒吸作用的仪器有____________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. 水溶液中NaHCO3电离:NaHCO3 = Na++H++CO32-
B. H2SO3电离:H2SO3![]() 2H++SO32-
2H++SO32-
C. HClO电离:HClO![]() H++ClO-
H++ClO-
D. 水溶液中NaHSO4电离:NaHSO4 = Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制 100 mL 1.00 mol/L NaCl 溶液,下列说法正确的是( )
A.将所需量的 NaCl 溶于 100 mL 水中
B.将所需量的 NaCl 溶于少量水中,再加水定容到 100 mL
C.将所需量的 NaCl 直接放入容量瓶中,加水定容到 100 mL
D.定容时俯视读刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。可由CO和水蒸气反应制备,其能量变化如下图所示。

(1)该反应为可逆反应。在800 ℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则此反应的平衡常数为___,随着温度升高该反应的化学平衡常数的变化趋势是___。(填“变大”、“变小”或“不变”)
(2)某温度下,该反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是____(填字母)。
起始浓度 | 甲 | 乙 | 丙 |
c(H2O)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015 mol·L-1
D. 平衡时,乙中H2O的转化率大于25%
(3)一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,达到平衡后:
2NH3(g) ΔH<0,达到平衡后:
①加催化剂,v(正)、v(逆)都发生变化,且变化的倍数__(填“相等”或“不相等”)。
②缩小体积使体系压强增大,则v(正)___,v(逆)___(填“增大”、“减小”或“不变”),v(正)变化的倍数__v(逆)变化的倍数(填“大于”、“小于”或“等于”)。
③降温,v(正) ____,v(逆)__(填“增大”、“减小”或“不变”)。
④温恒压,再通入一定量的He,达到新平衡时,N2的转化率__,c(H2)将__(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJmol-1
2CO(g)+2H2(g) △H=+247.0 kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_______________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
容器 | 起始物质的量(n) / mol | CO2的 平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_________。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(H2) = ________(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ_______n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
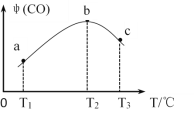
① T2℃时,CO体积分数最大的原因是_____________。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP =_______(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
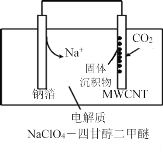
(4)2016年我国科研人员根据反应Na+CO2→ Na2CO3+C(未配平) 研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、解释或结论均正确的是
选项 | 实验目的 | 操作 | 结论或解释 |
A | 检验 | 取待测液少许,加入过量的 | 液体分层,加入硝酸酸化的 |
B | 检验某溶液中有无 | 取待测液少许,加入盐酸,有气体放出,将气体通入澄清石灰水中 | 澄清石灰水变浑浊,则含 |
C | 检验溶液中的 | 取待测液少许,先通入氯气,再加KSCN溶液 | 溶液变红色,则含 |
D | 检验食盐中是否含 | 取少量食盐溶于水,加少量淀粉 | 溶液变蓝色,则含 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com