
【题目】Ⅰ.铁是应用最广泛的金属,铁的卤化物、氯化物以及高价铁的含氧酸盐均为重要化合物。已知氧化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
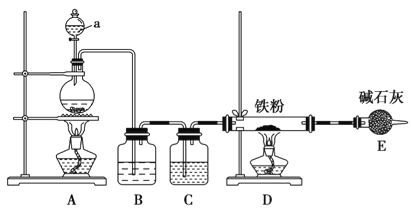
①装置A中发生的离子方程式_______________
②装置B的作用是________,C中的试剂______________。
③实验开始时先点燃___处酒精灯;装置E的作用为__________。
(2)工业上制备无水氯化铁的一种工艺流程如下:
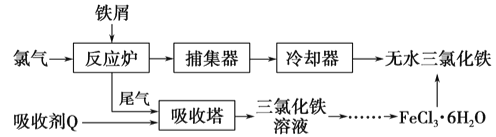
①吸收塔中发生反应的离子方程式为__________
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:____________
Ⅱ.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
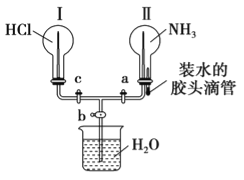
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______。
(2)若先打开a、c活塞,再挤压胶头滴管(假设NH3不能被完全吸收),在烧瓶Ⅱ中可观察到的现象是_____。
(3)通过挤压胶头滴管和控制活塞的开关,要在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________
【答案】 MnO2 + 4H++2Cl-=Cl2↑+Mn2++2H2O 除HCl 浓硫酸 A 防止外界空气中的水蒸气进入D,并吸收尾气 2Fe2++Cl2===2Fe3++2Cl- 在HCl气流中加热蒸干 先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞) Ⅱ中导管口处出现白烟 先打开a、c活塞,再挤压胶头滴管(或先打开a活塞挤压胶头滴管,再打开c活塞),片刻后关a活塞,再打开b活塞
【解析】Ⅰ.实验室制备无水氯化铁,需要先制取氯气,用A装置,根据题意B用于除去氯气中的氯化氢,C用于干燥氯气,由于无水氯化铁遇潮湿空气极易吸水生成FeCl3nH2O,所以E防止空气中的水蒸气进入,同时吸收未反应的氯气,防止污染空气。
①根据图示,装置A是制备氯气的装置,其中发生反应的离子方程式为MnO2 + 4H++2Cl-=Cl2↑+Mn2++2H2O,故答案为:MnO2 + 4H++2Cl-=Cl2↑+Mn2++2H2O;
②装置B的作用是:除去氯气中的氯化氢,C用于干燥氯气,C 中的试剂可以为:浓硫酸,故答案为:除去氯气中的氯化氢;浓硫酸;
③实验开始时先点燃A处酒精灯;装置 E的作用为:阻止外界空气中的水蒸气进入D,吸收尾气,故答案为:A;阻止外界空气中的水蒸气进入D,吸收尾气;
(2)氯气与铁在反应炉中反应生成氯化铁,尾气用吸收剂Q处理得到氯化铁,故Q为氯化亚铁,氯化铁溶液蒸发浓缩、冷却结晶得到氯化铁晶体,为防止氯化铁水解,在HCl气流中加热蒸干氯化铁晶体得到氯化铁。
①吸收塔中发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
②FeCl36H2O晶体得到无水氯化铁,应防止氯化铁水,需要在在HCl气流中加热蒸干,故答案为:在HCl气流中加热蒸干;
Ⅱ(1)若要在烧瓶Ⅱ中产生喷泉,烧瓶Ⅰ中不产生“喷泉”现象,应该先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开ab活塞),则在Ⅱ中氨气被水吸收形成负压,
故答案为:先打开ab活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞);
(2)若先打开a、c 活塞,Ⅰ中氯化氢进入Ⅱ中,氯化氢和氨气反应生成固体氯化铵,出现白烟,故答案为:Ⅱ中导管口处出现白烟;
(3)要在烧瓶Ⅰ中形成喷泉,就要形成负压:先打开ac活塞,再挤压胶头滴管,Ⅰ中氯化氢部分进入Ⅱ中,使Ⅰ中形成负压,关a活塞,再打开b活塞,故答案为:先打开a、c活塞,再挤压胶头滴管(或先打开a活塞挤压胶头滴管,再打开c活塞),片刻后关a活塞,再打开b活塞。


科目:高中化学 来源: 题型:
【题目】根据下列实验事实,不能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 | 醋酸的酸性强于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 |
D | 常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12 | 常温下,醋酸和氨水的电离平衡常数相等 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
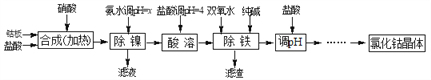
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是________________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
(1)①某温度下,若把 10 mol N2 与 30 mol H2置于体积为 10 L 的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为 20%,则该温度下反应的K=_______ (可用分数表示)。
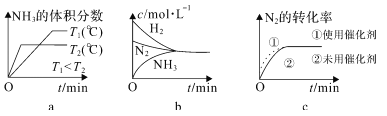
②对于合成氨反应而言,下列有关图像一定正确的是______(选填序号)。
③在碱性溶液中通过电解法可以实现由 N2 制取 NH3:2N2+6H2O![]() 4NH3+3O2,阴极的电极反应式是_______________。
4NH3+3O2,阴极的电极反应式是_______________。
(2)室温下,若将 0.1 mol·L-1 盐酸滴入 20 mL 0.1 mol·L-1 氨水中,溶液 pH 随加入盐酸体积的变化曲线如下图所示。
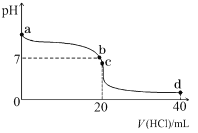
①NH3·H2O 的电离方程式是_______________。
②b 点所示溶液中的溶质是_______________。
③c 点所示溶液中,离子浓度从大到小的关系为_______________。
④常温下,若将 amol/LNH3·H2O 与等体积的 bmol/L 的盐酸混合,充分反应后溶液呈中性(不考虑氨水和盐酸的挥发),则该温度下 NH3·H2O 的电离常数Ka=___________(用含 a 和 b 的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
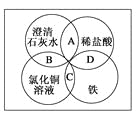
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃ 时,1LpH=1的H2SO4溶液中含有0.1NAH+
B. 常温常压下,18gD2O含有的质子数为10NA
C. 9.0g淀粉和葡萄糖的混合物中共含有0.3NA碳原子
D. 铜粉与硫粉混合加热,每消耗1mol铜粉,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式__________________________________________
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应。氧化产物为__________
(3)当0.1 mol MnO2参加反应时,转移电子数为____,被氧化的HCl为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列晶体分类中正确的一组是( )
离子晶体 | 原子晶体 | 分子晶体 | |
A | NaOH | Ar | SO2 |
B | H2SO4 | 石墨 | S |
C | CH3COONa | SiO2 | CO2 |
D | Ba(OH)2 | 金刚石 | 玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )
A.元素
B.原子
C.分子
D.单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com