
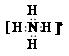
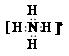
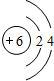 ,所以碳元素位于第二周期第IVA族,其核外电子排布式为1s22s22p2,该原子核外电子共占据一个1s、一个2s、两个2p共4个轨道,故答案为:第二周期IVA族,4;
,所以碳元素位于第二周期第IVA族,其核外电子排布式为1s22s22p2,该原子核外电子共占据一个1s、一个2s、两个2p共4个轨道,故答案为:第二周期IVA族,4;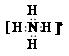 ,碳酸氢根离子水解程度大于铵根离子而使碳酸氢铵溶液呈碱性,水解方程式为:HCO3-+H2O?H2CO3+OH-,故答案为:
,碳酸氢根离子水解程度大于铵根离子而使碳酸氢铵溶液呈碱性,水解方程式为:HCO3-+H2O?H2CO3+OH-,故答案为: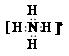 ,HCO3-+H2O?H2CO3+OH-;
,HCO3-+H2O?H2CO3+OH-;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com