
Ļ”ČÜŅŗÖŠ£¬ČÜÖŹµÄ“ęŌŚ½«ŅżĘšČܼĮµÄÄż¹ĢµćĻĀ½µŗĶ·ŠµćÉĻÉż£¬ŗ£Ė®ŌŚ0”ę²»»į½į±ł¾ĶŹĒÕāøöµĄĄķ”£Äż¹ĢµćĻĀ½µµÄ³Ģ¶ČÓėČÜÖŹµÄ·Ö×ÓŹżÓŠ¹Ų£¬¶ųÓėČÜÖŹŹĒŗĪÖÖĪļÖŹĪŽ¹Ų”£µ±ČܼĮµÄĮæČ·¶ØŹ±£¬Äż¹ĢµćĻĀ½µÓėČÜÖŹµÄ·Ö×ÓŹż³ÉÕż±Č”£ŅŃÖŖ10.0gÕĮÄŌÖŠČܽāĮĖ0.412gÄĪ£¬ÕĮÄŌµÄÄż¹ĢµćĻĀ½µĮĖ13”ę£¬Ä³ÖÖC”¢H”¢O×é³ÉµÄÓŠ»śĪļ2.30g£¬ČܽāÓŚ15.6gÕĮÄŌÖŠ£¬ÕĮÄŌµÄÄż¹ĢµćĻĀ½µĮĖ49.5”ę”£ÓÉ“ĖæÉÖŖ“ĖÓŠ»ś»ÆŗĻĪļµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ
A£®240 B£®60 C£®120 D£®128
 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 pCĄąĖĘpH£¬ŹĒÖø¼«Ļ”ČÜŅŗÖŠČÜÖŹĪļÖŹµÄĮæÅØ¶ČµÄ³£ÓƶŌŹżøŗÖµ£®ČēijČÜŅŗČÜÖŹµÄÅضČĪŖ1”Į10-3mol/L£¬ŌņČÜŅŗÖŠøĆČÜÖŹµÄpC=-lg10-3=3£®ŅŃÖŖH2CO3ČÜŅŗÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗ
pCĄąĖĘpH£¬ŹĒÖø¼«Ļ”ČÜŅŗÖŠČÜÖŹĪļÖŹµÄĮæÅØ¶ČµÄ³£ÓƶŌŹżøŗÖµ£®ČēijČÜŅŗČÜÖŹµÄÅضČĪŖ1”Į10-3mol/L£¬ŌņČÜŅŗÖŠøĆČÜÖŹµÄpC=-lg10-3=3£®ŅŃÖŖH2CO3ČÜŅŗÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗ| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| 1 |
| 2 |
| Ź±¼ä/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c£ØNH3£©/£Ømol?L-1£© | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 “ĖĢõ¼žĻĀ£¬øĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāŹ±£¬µŖĘųµÄÅضČĪŖ
“ĖĢõ¼žĻĀ£¬øĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāŹ±£¬µŖĘųµÄÅضČĪŖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗÉč¼Ę±ŲŠŽŅ»»ÆѧĀ³æĘ°ę Ā³æĘ°ę ĢāŠĶ£ŗ022
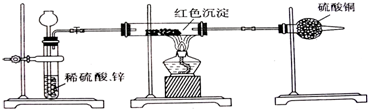
µē½āÖŹµÄµēĄė
Ėį”¢¼ī”¢ŃĪŹĒµē½āÖŹ
(1)µē½āÖŹŗĶ·Ēµē½āÖŹ
µē½āÖŹŹĒÖøČÜÓŚ________Äܹ»µ¼µēµÄ»ÆŗĻĪļ£»·Ēµē½āÖŹŹĒÖø________µÄ»ÆŗĻĪļ£®Zn”¢FeµČ½šŹōŌŚČŪȌדĢ¬ĖäÄܵ¼µē£¬µ«ĖüĆĒ²»ŹĒ»ÆŗĻĪļ£¬Ņņ¶ų²»ŹĒ________£¬Ņ²²»ŹĒ________£®
»īĘĆ½šŹōµÄŃõ»ÆĪļ£¬ČēNa2O”¢Al2O3µČ£¬ŌŚČŪȌדĢ¬ĻĀÄܹ»µ¼µē£¬ŹĒÓÉÓŚĖüĆĒ×ŌÉķµēĄė³öĄė×ÓµÄŌµ¹Ź£¬Ņņ¶ųŹĒµē½āÖŹ£ŗ
Na2O(ČŪ)![]()
Al2O3(ČŪ)![]()
(2)Ēæµē½āÖŹŗĶČõµē½āÖŹ
Ēæµē½āÖŹŹĒÖøŌŚĖ®ČÜŅŗĄļČ«²æµēĄė³ÉĄė×ӵĵē½āÖŹ£»Čõµē½āÖŹŹĒÖøŌŚĖ®ČÜŅŗĄļÖ»ÓŠŅ»²æ·Ö·Ö×ÓµēĄė³ÉĄė×ӵĵē½āÖŹ£®Ąķ½āÕāĮ½øöøÅÄī£¬Ó¦×¢ŅāŅŌĻĀ¼øµć£ŗ
¢ŁĒ攢Čõµē½āÖŹµÄ»®·Ö±ź×¼ŹĒŌŚĖ®ČÜŅŗÖŠµē½āÖŹµÄµēĄė³Ģ¶Č£®________µÄŹĒĒæµē½āÖŹ£¬________µÄŹĒČõµē½āÖŹ£®
¢ŚĒ攢Čõµē½āÖŹµÄøÅÄī£¬²»ÄÜŹŹÓĆÓŚĖłÓŠµē½āÖŹ£¬ČēNa2OµČÓėĖ®·“Ó¦µÄĄė×Ó»ÆŗĻĪļ£¬±»ČĻ¶ØŹĒĒæµē½āÖŹ£®
¢ŪĒ攢Čõµē½āÖŹÓėĪļÖŹµÄČܽāŠŌ²»ŹĒĶźČ«Ļą¹ŲµÄ£®ČēCaCO3µČĖä¼øŗõ²»ČÜÓŚĖ®£¬Č“ŹĒĒæµē½āÖŹ£»CH3COOHĖäæÉÓėĖ®ŅŌČĪŅā±Č»ģČÜ£¬Č“ŹĒČõµē½āÖŹ£»C2H5OHĖäæÉÓėĖ®ŅŌČĪŅā±Č»ģČÜ£¬Č“ŹĒ·Ēµē½āÖŹ£®
¢ÜĒ攢Čõµē½āÖŹÓėČÜŅŗµÄµ¼µēŠŌĒæČõŅ²²»ŹĒĶźČ«Ļą¹ŲµÄ£®ČÜŅŗµÄµ¼µēŠŌĒæČõÖ÷ŅŖŹĒÓÉČÜŅŗÖŠ________¾ö¶ØµÄ£¬Ēæµē½āÖŹĻ”ČÜŅŗÖŠĄė×ÓµÄÅØ¶Č²»Ņ»¶Ø±ČČõµē½āÖŹÅØČÜŅŗÖŠµÄĄė×ÓÅØ¶Č“ó£¬Ņņ¶ųµ¼µēŠŌ²»Ņ»¶ØĒ森
¢ŻĒ攢Čõµē½āÖŹČÜŅŗÖŠ£¬ČÜÖŹµÄ“ęŌŚŠĪŹ½²»Ķ¬£®Ēæµē½āÖŹČÜŅŗÖŠČÜÖŹµÄ“ęŌŚŠĪŹ½ŹĒ________£¬Čõµē½āÖŹČÜŅŗÖŠ³żŅõ”¢ŃōĄė×ÓĶā£¬»¹“óĮæ“ęŌŚČÜÖŹµÄ________£®
(3)µē½āÖŹÓėĻø°ū»ī¶ÆK+”¢Na+”¢Cl£¶ŌĪ¬³ÖĻø°ūÄŚĶāĢåŅŗÖŠµÄĖ®ŗĶµē½āÖŹĘ½ŗā·¢»Ó×ÅÖŲŅŖ×÷ÓĆ£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com