
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、向H2O中投入少量Na218O2固体:2H2O+2Na218O2═4Na++418 OH-+O2↑ |
| D、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |


科目:高中化学 来源: 题型:
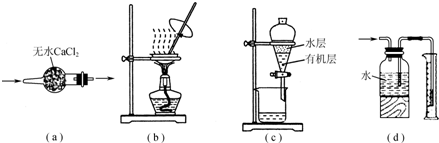
| A、用图a所示装置干燥SO2气体 |
| B、用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体 |
| C、用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 |
| D、用图d所示装置测量氨气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 解释或结论 | ||||
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 | SO2具有漂白性 | ||||
| B | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) | ||||
| C | 某钾盐溶于盐酸,产生无色无味气体,该气体通入澄清石灰水,有白色沉淀出现 | 该钾盐可能是K2CO3 | ||||
| D | NaI溶液
|
酸性条件下H2O2的氧化性比I2强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(H2S):通过CuSO4溶液 |
| B、CH3COOH(H2O):加新制生石灰,蒸馏 |
| C、苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 |
| D、MgCl2溶液(Fe3+):加MgO,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
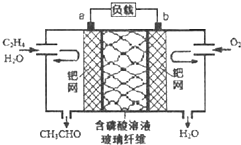 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、每有0.1mol O2反应,则迁移H+0.4mol |
| C、正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O |
| D、电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA |
| B、标准状况下,44.8L NO与22.4L O2混合后气体中分子总数等于2NA |
| C、1mol Fe在氧气中充分燃烧失去3NA个电子 |
| D、NO2和H2O反应每生成2mol HNO3时转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ①②③ | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH<7 |
| A、HA的电离方程式为:HA?H++A- |
| B、不考虑其他组的实验结果,c≥0.2 |
| C、③组实验中,混合溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D、①组实验中,混合溶液中c(A-)=(0.1+10-9-10-5)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com