
| A. | 由H、N、O三种元素形成的化合物中一定含有共价键 | |
| B. | 正戊烷、异丁烷和丙烷属于同系物,沸点依次升高 | |
| C. | 葡萄糖能发生银镜反应,蔗糖、麦芽糖也能发生银镜反应 | |
| D. | 用KSCN溶液检验Fe3+的实验现象是产生血红色沉淀 |
分析 A.由H、N、O三种元素形成的化合物中可能只含有共价键、可能含有共价键和离子键;
B.烷烃中,碳原子个数越多其熔沸点越高;
C.蔗糖不含醛基,不能发生银镜反应;
D.铁离子能和KSCN溶液反应生成络合物而使溶液呈血红色.
解答 解:A.H、N、O三种元素形成的化合物中一定有共价键,如硝酸、硝酸铵,故A正确;
B.烷烃中,碳原子个数越多其熔沸点越高,正戊烷、异丁烷和丙烷均属于烷烃的同系物,随碳原子数的减少,沸点降低,故B错误;
C.蔗糖为非还原性糖,不能发生银镜反应,故C错误;
D.KSCN溶液与Fe3+反应的现象为溶液变血红色,故D错误;
故选A.
点评 本题考查化学键、物质熔沸点判断、官能团检验、离子检验等知识点,明确物质结构及性质是解本题关键,知道官能团的检验方法、常见离子的检验方法,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,烷烃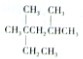 的名称是2,4-二甲基-2-乙基戊烷 的名称是2,4-二甲基-2-乙基戊烷 | |
| B. | 丙烯酸(CH2=CH-COOH)能发生取代加聚缩聚反应 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下都能发生水解反应 | |
| D. | 等物质的量的HCOOCH3和CH3CHO完全燃烧,产物均通过足量的过氧化钠并充分反应,固体增重相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水有“元素故乡”之称,溴被称为“海洋元素” | |
| B. | 发展氯碱工业是利用海水的一大方向,其中氯气是氧化产物,H2是还原产物 | |
| C. | 工业上从海水中获取NaCl和AlCl3,通过电解其熔融盐可获得金属Na和Al | |
| D. | 利用海水通过物理变化可以获得淡水和食盐,但从海水中获取MgCl2和Br2必须通过化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
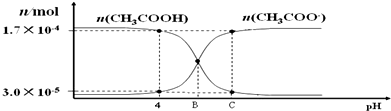
| A. | 醋酸的电离常数的表达式如下Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ | |
| B. | pH=4 时,醋酸的电离常数 Ka≈1.8×10-5 | |
| C. | B点时的溶液中滴入酚酞溶液,显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
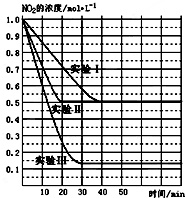 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物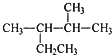 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、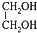 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: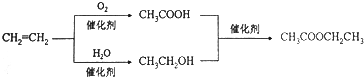 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
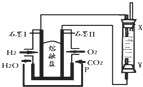 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com