
设NA代表阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下2.24 L H2O中,分子数为0.1NA
B.将1 mol Cl2通入到水中,所得氯水中有:n(HClO)+n(Cl-)+n(ClO-)=2NA
C.常温常压下16 g O2和O3混合气体中,氧原子数为NA
D.7.8 g Na2O2与足量水反应,转移电子数为0.2NA
科目:高中化学 来源: 题型:
为测定某碳酸氢钠样品的纯度(含有少量氯化钠),实验小组同学提出下列实验方案:
甲方案:沉淀法
乙方案:重量法
丙方案:气体体积法
丁方案:滴定法
(已知:每个方案均称取m1 g样品)
继而进行下列判断和实验:
(1)甲方案用下图装置进行实验:
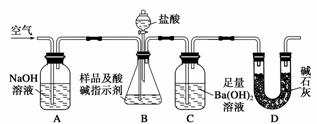
①实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有__________。
②C中反应生成BaCO3的化学方程式是__________。
③下列各项措施中,不能提高测定准确度的是________。
a.在加入盐酸之前,应排尽装置内的CO2气体
b.滴加盐酸不宜过快
c.在A、B之间增添盛有浓硫酸的洗气装置
d.在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(2)乙方案用下图装置进行实验:
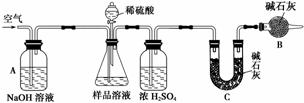
①A装置中NaOH溶液的作用是____________,若直接向试样溶液中鼓入空气会导致实验测定结果__________(填“偏高”、“偏低”或“无影响”);
②该方案需直接测定的物理量是________。
(3)丙方案用如图装置进行实验:
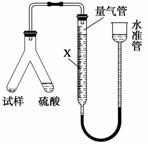
①为了减小实验误差,量气管中加入的液体X为______溶液;
②使Y形管中的硫酸溶液与试样反应的正确操作是将________转移到________中;
③反应完毕,每间隔1 min读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是__________________(排除仪器和实验操作的影响因素);
④通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是________。
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的液面高于量气管的液面
c.Y形管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
(4)丁方案为称取m1 g样品,配成100 mL溶液,取出20 mL,用c mol·L-1的标准HCl溶液滴定至终点,平行测定三次,有关实验数据记录如下表,则该试样中碳酸氢钠质量分数的计算式为________。
| 实验 编号 | 待测液 体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 终点时读数 | ||
| 1 | 20.00 | 0.00 | 30.02 |
| 2 | 20.00 | 0.20 | 33.80 |
| 3 | 20.00 | 1.40 | 31.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关工业生产的叙述正确的是( )
A.钢管被原油中的含硫化合物腐蚀是电化学腐蚀
B.粗锌与稀硫酸反应制氢气比纯锌快,是因 为粗锌比纯锌还原性强
为粗锌比纯锌还原性强
C.铁板镀锡属于电化学防护
D.生铁浸泡在食盐水中发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列实验事实所得出的结论或给出的解释正确的是( )
| 实验事实 | 结论或解释 | |
| A | 将40 g NaOH溶于1 L蒸馏水中 | 该溶液中溶质的质量分数为3.84%,其物质的量浓度为1 mol·L-1 |
| B | 向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 | 还原性Al<Cu |
| C | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| D | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O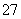 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________和________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物F是合成一种新型降压药替米沙坦的中间体,可由下图所示的路线合成:

(1)B的结构简式为________________。
(2)反应①~⑤中,属于取代反应的是________;
A—→B的反应类型____________。
(3)C—→D的化学方程式为__________________。浓H2SO4的作用是________;使用过量CH3OH的作用是__________。
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是__________(写结构简式)。
(5)满足下列条件的B的所有同分异构体有________种,其中苯环上只有一个取代基的结构简式:______________。
①含苯环;②含酯基;③能与新制氢氧化铜悬浊液反应生成砖红色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
| 选项 | 事实 | 结论 |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 可用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | 氧化铜高温下生成砖红色物质,该物质可与稀硫酸反应 | 氧化铜高温下可分解生成Cu2O |
| D | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. (1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
(g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是________,NO分子中化学键的键能为________kJ·m ol-1。
ol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.
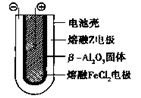
 熔融状态下,
熔融状态下, 钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2  Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为_______ _______________;
_______________;
充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com