
| X | Y | Z | |
| A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
| B | H2 | SO2 | NaOH 溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D | SiO2 | Fe2O3 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Z只能检验Y,不能除杂;
B.二氧化硫与NaOH反应,而氢气不能;
C.硫酸亚铁与氯气反应引入新杂质氯离子;
D.二氧化硅与NaOH反应.
解答 解:A.Z只能检验Y,不能除杂,应选铁粉除杂,故A错误;
B.二氧化硫与NaOH反应,而氢气不能,则NaOH溶液可除杂,故B正确;
C.硫酸亚铁与氯气反应引入新杂质氯离子,不能除杂,应选过氧化氢,故C错误;
D.二氧化硅与NaOH反应,将原物质除去,不能除杂,应选盐酸、过滤,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
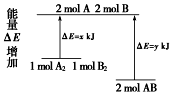
| A. | 该反应的反应热△H=x-y kJ/mol | |
| B. | 断裂1 mol A-A键和1 mol B-B键放出x kJ能量 | |
| C. | 2 mol AB的总能量高于1 mol A2和1 mol B2总能量 | |
| D. | 该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+═2Fe2+ | |
| B. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
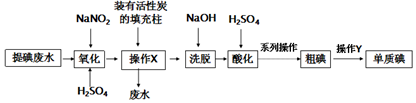
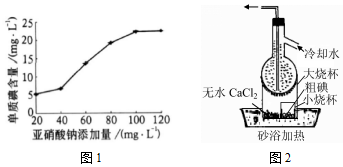 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
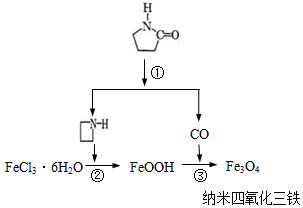 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中,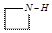 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体中一定不含有CuSO4、FeCl3 | |
| B. | 固体中一定不含有Na2CO3、一定含有Na2SO4 | |
| C. | 固体中一定含有FeCl2,不一定含有NaCl | |
| D. | 要检验固体中有没有MgCl2,需再取一份溶液,滴加NaOH溶液,若产生白色沉淀,则含有MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸共热制氯气 | B. | 煅烧黄铁矿(FeS2)制SO2 | ||
| C. | 氯气与石灰乳反应制漂白粉 | D. | 电解熔融氯化镁制金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com