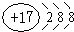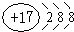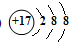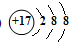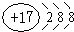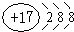【答案】
分析:短周期中的A、B、C、D、E 5种元素,原子序数依次增大.C
2-离子与D
+离子的核外电子数相等,由于是短周期元素,则C位于第二周期,为O元素,D位于第三周期,为Na元素;B原子与D
+离子的核外电子数之和等于E原子的核外电子数,则E原子的核外电子数大于10,且D、E两元素能形成微粒个数比为1:1的离子化合物,E形成-1价离子,则E为Cl元素,B元素的核外电子数为17-10=7,故B为N元素;A、D同主族;A、B的原子序数之和等于C的原子序数,则A为H元素,据此解答.
解答:解:短周期中的A、B、C、D、E 5种元素,原子序数依次增大.C
2-离子与D
+离子的核外电子数相等,由于是短周期元素,则C位于第二周期,为O元素,D位于第三周期,为Na元素;B原子与D
+离子的核外电子数之和等于E原子的核外电子数,则E原子的核外电子数大于10,且D、E两元素能形成微粒个数比为1:1的离子化合物,E形成-1价离子,则E为Cl元素,B元素的核外电子数为17-10=7,故B为N元素;A、D同主族;A、B的原子序数之和等于C的原子序数,则A为H元素,
即A为H元素,B为N元素,C为O元素,D为Na元素,E为Cl元素.
(1)E为Cl元素,E元素形成的离子为氯离子,核内质子数为17,核外有18的电子,其离子结构示意图为
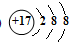
,
故答案为:

;
(2)A为H元素,B为N元素,C为O元素,A与B元素、A与C元素均可构成18电子的分子,其化学式分别为N
2H
4、H
2O
2,故答案为:N
2H
4;H
2O
2;
(3)A为H元素,B为N元素,C为O元素,D为Na元素
①A、B、C、D中的任意三种元素可组成多种化合物,X和Y是其中的两种.X 和Y都是既含离子键又含共价键的离子化合物,则X 和Y为盐或碱;
将X、Y分别溶于水时,X能促进水的电离,X水溶液的pH<7,则X为铵盐,X为NH
4NO
3;
而Y能抑制水的电离,Y水溶液的pH>7,则Y为碱,故Y为NaOH,故答案为:NH
4NO
3;NaOH;
②将0.2mol?L
-1的NH
4NO
3溶液与0.1mol?L
-1的NaOH溶液等体积混合,则混合后发生反应,相当于NH
4NO
3、NH
3?H
2O、NaNO
3等物质的量混合.溶液呈碱性,进行说明NH
4+水解小于NH
3?H
2O电离程度,则c(NH
4+)>c(Na
+ ),故混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为:c(NO
3-)>c(NH
4+)>c(Na
+ )>c(OH
-)>c(H
+),
故答案为:c(NO
3-)>c(NH
4+)>c(Na
+ )>c(OH
-)>c(H
+);
(4)平衡时N
2的浓度为0.01mol/L,则参加反应的氮气的物质的量为1mol-0.01mol/L×10L=0.9mol,故1mol氮气反应放出的热量为83.2kJ×
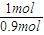
=92.4kJ,故反应热化学方程式为N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4 kJ/mol,故答案为:N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4 kJ/mol.
点评:本题考查原子结构与元素周期律,题目较为综合,涉及常用化学用语、离子浓度大小比较、热化学方程式书写等,难度中等,推断元素解答该题的关键.

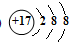 ,
, ;
;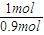 =92.4kJ,故反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.
=92.4kJ,故反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案