
【题目】二氧化氮是能引起酸雨的一种物质. 二氧化氮属于( )
A.酸
B.非金属氧化物
C.碱
D.混合物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有关乙烷、乙烯、乙炔、苯分子结构的比较错误的是( )
A.乙烷、乙烯、乙炔、苯中各原子均处于同一平面上
B.碳碳键长:乙烷>苯>乙烯>乙炔
C.碳碳键键能:乙炔>乙烯>苯>乙烷
D.键角:乙炔>乙烯═苯>乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
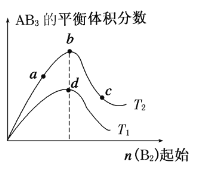
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )
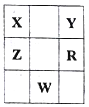
A. 原子半径大小关系为:R>Y>X
B. X有多种同素异形体,而Y不存在同素异形体
C. 根据元素周期律可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性
D. 氢化物熔沸点:H2R>H2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
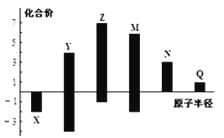
A. 金属性:N>Q
B. 最高价氧化物对应水化物酸性:M>Y>N
C. 简单离子半径:Q>N>X
D. 原子序数:Z>M>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、鞣革还原剂、脱氯剂等。它受热、遇酸易分解。它有多种制备方法,其中硫化碱法为:向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,经吸硫、蒸发、结晶,制得硫代硫酸钠晶体。制备过程中发生的主要反应如下:
Na2S + H2O + SO2 → Na2SO3 + H2S ………… (i)
2H2S + SO2 → 3S + 2H2O …………………… (ii)
S + Na2SO3 —△→ Na2S2O3 …………………(iii)
(1)已知Na2S2O3分解反应是吸热反应,由此可得出:该分解反应中,反应物断裂化学键所吸收的总能量_________(填“大于”、“小于”或“等于”)生成物形成化学键所放出的总能量。
(2)Na2S2O3具有还原性,判断依据是_________、_________(至少写出两条)。
(3)上述反应i ~ iii总反应的化学方程式为_________。制备过程中,即使将反应物的用量按化学方程式的计量数进行配比,反应后各反应物仍有剩余,这说明该过程中存在_________。
(4)为了保证硫代硫酸钠的产量,生产中通入的SO2不能过量,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。下列有关评价正确的是
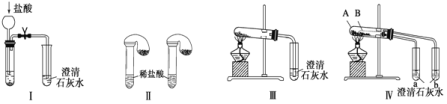
A.根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体
B.在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体
C.与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
D.若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com