
有如下3个实验:
| 实验1 | 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 实验2 | 将片状的金属X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
| 实验3 | 用惰性电极电解等物质的量浓度的Y和金属Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
依据上述实验现象,下列推测中正确的是 ( )
A.金属的活动性顺序:Y>Z>X>W
B.实验1中,Y作正极
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,X作正极
科目:高中化学 来源: 题型:
在某无色透明的酸性溶液中,能共存的离子组是( )
|
| A. | Na+、K+、SO42﹣、HCO3﹣ | B. | Cu2+、K+、SO42﹣、NO3﹣ |
|
| C. | Na+、K+、Cl﹣、NO3﹣ | D. | Fe3+、K+、SO42﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中进行下列反应:2SO2(g)+O2(g)⇌2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L﹣1、0.1mol•L﹣1、0.2mol•L﹣1,当反应达到平衡时,可能存在的数据是( )
|
| A. | SO2为0.4mol•L﹣1,O2为0.2 mol•L﹣1 |
|
| B. | SO2为0.15 mol•L﹣1 |
|
| C. | SO2,SO3均为0.25 mol•L﹣1 |
|
| D. | SO3为0.4 mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分析如图所示的四个原电池装置,结论正确的是( )
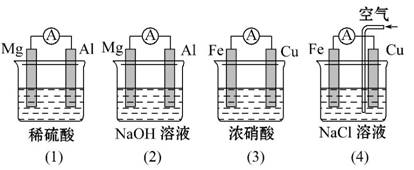
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-====6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-====Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-====H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS====Na2Sx,正极的电极反应式为 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS====Na2Sx,正极的电极反应式为 。
M(由Na2O和Al2O3制得)的两个作用是 。
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 。理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )
|
| A. |
是等质量的两份锌粉a、b分别加到过量的稀硫酸中,同时向a中加入少量CH3COONa溶液,产生H2的体积V(L)与时间t(min)的关系图 |
|
| B. |
足量CO2不断通入含KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的体积的关系图 |
|
| C. |
由图可知,双氧水在有催化剂存在时的热化学方程式为:2H2O2(l)=2H2O(l)+O2(g)△H=﹣2(Ea2′﹣Ea2) kJ•mol﹣1 |
|
| D. |
装置图能实现铁上镀锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A. 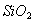 是酸性氧化物,能与溶液反应
是酸性氧化物,能与溶液反应
B. 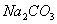 和
和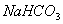 都是盐,都能与溶液反应
都是盐,都能与溶液反应
C.  和
和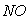 都是大气污染物,在空气中都能稳定存在
都是大气污染物,在空气中都能稳定存在
D. Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com