
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯 | B. | 二甲苯 | C. | 苯 | D. | 环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl3+2H2O
+3FeCl3+2H2O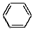 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
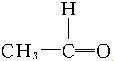 +
+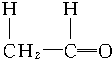 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$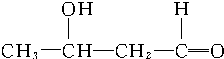
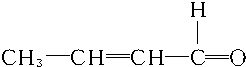 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$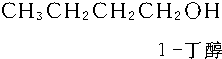
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
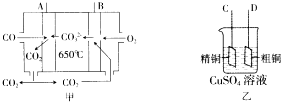 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
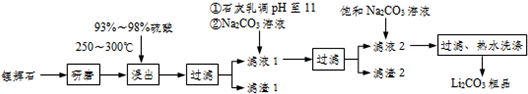
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com