
����Ŀ��X��Y��Z��R��W��ԭ���������ε��������ֶ���������Ԫ�أ���������������֮��Ϊ11������YԪ���������ͻ��ϼ۵Ĵ�����Ϊ2��Y��Z�ĵ������ɵĻ�������һ�ִ�������Ϣ�ġ���ʹ���ӡ���R��ԭ�Ӱ뾶������Ԫ�������ģ�Y��W��ͬ��Ԫ�ء�����˵��������ǣ� ��
A. �����ӵĻ�ԭ�ԣ�Y>Z
B. R�ĵ��ʿ����ǽ�����ǽ���
C. ��X��Z��W���ɵ���һ������Ԫ��
D. ��״���£�1molYZ��0.5mol![]() ��Ϻ�������������һ��С��22.4L
��Ϻ�������������һ��С��22.4L
���𰸡�C
��������
YԪ��ΪNԪ�أ�WԪ��ΪPԪ�أ�����ʹ������ΪNO����ZԪ��ΪOԪ�أ�R��ԭ�Ӱ뾶������Ԫ�������ģ�����ӦΪ�������ڵ�Na��Mg��Al��Si����XԪ��ΪHԪ�ء�
A. ���Ӱ뾶Խ��Խ��ʧȥ���ӣ����ӻ�ԭ��Խǿ���뾶��![]() ����ԭ�ԣ�
����ԭ�ԣ�![]() ����A��ȷ��
����A��ȷ��
B. R����ΪNa��Mg��Al��Si���ǽ�����ǽ�������B��ȷ��
C. H��O��PҲ���ܹ���һԪ��![]() �ȣ���C����
�ȣ���C����
D. ����2![]() ������1mol NO��0.5mol
������1mol NO��0.5mol![]() ��Ϻ�������������ʵ���С��1mol��������ڱ�״����һ��С��22.4L����D��ȷ��
��Ϻ�������������ʵ���С��1mol��������ڱ�״����һ��С��22.4L����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ�����ĺ��IJ���������ӵ�أ��������������(LiFePO4)���缫���ϡ���LiFePO4�Ͼɵ缫��������Al��ʯī�ۣ����ղ���øߴ�Li2CO3�Ĺ�ҵ������ͼ��
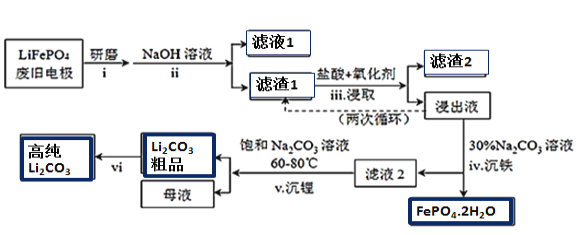
���ϣ�̼�����ˮ���ܽ�����¶ȱ仯���£�
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)����i��ĥ�����Ŀ����__________________��
(2)����ii��������NaOH��Һ������(�û�ѧ��Ӧ����ʽ��ʾ)_________________��
(3)�����iii����NaClO3��Ϊ��������������лᷴӦ�ᷢ������Ӧ���ɻ���ɫ���壬
���ø���Ӧ��Ӧ�����ӷ���ʽΪ_______________________________________________________��
�ӻ����Ƕȷ�����ѡ��___________(����ĸ)��Ϊ�ù��̵�����������á�
a.H2O2 b.Ũ���� c.ŨHNO3
������iii�õ��Ľ���Һѭ�����ε�Ŀ����________________________________________________��
(4)����Һ�д��ڴ���H2PO4����HPO42-����֪��![]() �����ƽ���ƶ�ԭ����������iv�õ������������ԭ��______________________________________��
�����ƽ���ƶ�ԭ����������iv�õ������������ԭ��______________________________________��
(5)��������vi�IJ���______________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�2 mol O2��2 mol H2O��Ƚϣ�����������ȷ����
A.���������B.������
C.�������D.ԭ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�С�����÷���м��������S��Ԫ�أ�Ϊԭ���Ʊ����������������ؾ���![]() ���ⶨ����ɡ�ʵ��һ���Ʊ����������
���ⶨ����ɡ�ʵ��һ���Ʊ����������![]() ��С��ͬѧ�����ͼ��ʾװ�ã��г�������ȥ����
��С��ͬѧ�����ͼ��ʾװ�ã��г�������ȥ����
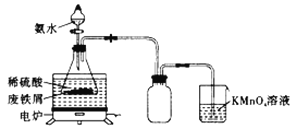
��ȡһ�����ķ���м����ƿ�У�����������ϡ���ᣬ��ͨ���������50��60����ˮԡ�м��ȣ���ַ�Ӧ������ƿ����Һ��ȴ����백ˮ������ʹ�䷴Ӧ��ȫ���Ƶ�dz��ɫ����Һ��
��1������м��ʹ��ǰ��Ҫ���ȵı���̼������Һ����ϴ�ӣ�Ŀ����______________________________��
��2����ʵ����ѡ��50��60����ˮԡ��ԭ����___________________________��![]() ��Һ��������________________________��
��Һ��������________________________��
��3����Ҫȷ�����dz��ɫ����Һ��ʵ�����Ӧע�����___________������ĸ����
a��������м���� b��������Һ��ǿ���� c�����������¶�
ʵ������Ʊ����������������ؾ��塣
ʵ��С����ʵ��һ��ƿ�е�����Һ�������ʵ�������Ʊ����������������ؾ��塣
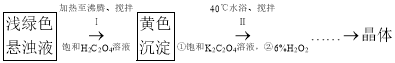
��4��д����������ɻ�ɫ����![]() �Ļ�ѧ����ʽ��____________________��
�Ļ�ѧ����ʽ��____________________��
��5��С��ͬѧȷ��ȡ��mg����м���������ϲ��裨�����������û����ʧ���õ����������������ؾ��岢���Ƴ���250mL��Һ��ȡ25mL����Һ����ƿ�У�����![]() ������Һ15mL�������������������ָʾ������
������Һ15mL�������������������ָʾ������![]() ��
��![]() ��Һ�ζ����Ϻ�ɫ������������ƽ��ʵ�飬ƽ�����ı�Һ
��Һ�ζ����Ϻ�ɫ������������ƽ��ʵ�飬ƽ�����ı�Һ![]() ����֪
����֪![]() �����Խ����б���ԭΪ
�����Խ����б���ԭΪ![]() �������м����Ԫ�ص���������Ϊ________���������ĸ��ʾ����
�������м����Ԫ�ص���������Ϊ________���������ĸ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������нṹʾ��ͼ���ж�����˵������ȷ����
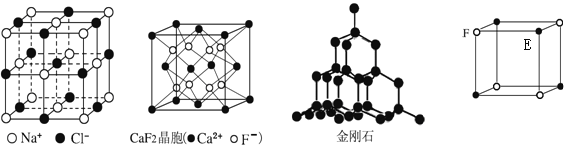
A. ��NaCl�����У���Na+����Ķ��Cl-������������
B. ��CaF2�����У�Ca2+����λ��Ϊ4
C. �ڽ��ʯ�����У�̼ԭ����̼̼����֮��Ϊ1��2
D. ����̬�Ŵط��ӵķ���ʽΪEF��FE
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������´��ڷ�Ӧ��H2(g)+I2(g) ![]() 2HI(g) ��H<0.����������ͬ��1L���ݾ���(�����û����������)̬���������ڢ��г���lmolH2��1mol��2(g)���ڢ��г���2molHl(g).�ڢ��г���2molH2��2molI2 (g)��700�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����()
2HI(g) ��H<0.����������ͬ��1L���ݾ���(�����û����������)̬���������ڢ��г���lmolH2��1mol��2(g)���ڢ��г���2molHl(g).�ڢ��г���2molH2��2molI2 (g)��700�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����()
A. �������з�Ӧ������ͬ
B. �������з�Ӧ��ƽ�ⳣ����ͬ
C. �������е�������ɫ���������е�������ɫdz
D. ��������H2��ת��������������HI��ת��֮��С��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ľ������������ڸ���Ԫ�صľ������롣
��1��������һ���ʳ�������������� 6g��
����ȥ NaCl��Һ�е�SO42-�����μ������ҺΪ�������ʵĻ�ѧʽ��������______��Һ������______��Һ������ϡ���ᡣ
��ʳ�õ�����ʳ���м��� KIO3���±���ij���г������۵�һ�����ӵ�������װ�ϵIJ�������˵�����ش��������⣺
���ϱ� | ���ƺ��Ρ�����أ�KIO3�� |
������ | 20~40 mg/kg |
���ط��� | �ܷ�ܹ⡢���� |
ʳ�÷��� | ���ʱ��ʳƷ��������� |
ʳ�õ�������������ָ______��������������������Ԫ���������Ʋ������أ�KIO3����ѧ���ʣ�����أ�KIO3���ڸ���ʱ______�������ֽ����������ֽ�������һ�ֲⶨ�������Ļ�ѧԭ���ǣ�
������KIO3 + KI + H2SO4===K2SO4 + I2 + H2O��δ��ƽ����
������I2 + 2Na2S2O3 = 2NaI + Na2S4O8������Ӧ �� ��дΪ���ӷ���ʽ_____
��2������ÿ���ʳ������ȡ 0.8 g Ca Ԫ�ء�0.3 g Mg Ԫ�ء�
��Ca Ԫ���� Mg Ԫ�����ʵ���֮��Ϊ______��
��ī��Ƿ�(��Ҫ�ɷ��� CaCO3��������������θ����࣬��ԭ����_________(�����ӷ���ʽ�ش�)��
���Ӻ�ˮ�п���ȡþ����ȥ���� Mg(OH)2 �е� Ca(OH)2 ����ѷ����ǣ����������______������A������B������A. MgSO4 ��Һ��B. MgCl2 ��Һ�������ˣ�ϴ�ӣ����º�ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X(g)+2Y(g)![]() 3Z(g) ��H=-akJ��mol-1(a>0)������˵������ȷ����
3Z(g) ��H=-akJ��mol-1(a>0)������˵������ȷ����
A. 0.1molX��0.2molY��ַ�Ӧ����Z�����ʵ���һ��С��0.3mol
B. �ﵽ��ѧƽ��״̬ʱ��X��Y��Z��Ũ�Ȳ��ٷ����仯
C. �ﵽ��ѧƽ��״̬ʱ����Ӧ�ų����������ɴ�a Kj
D. ���߷�Ӧ�¶ȣ��淴Ӧ������������Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ҩ���ƹ����з��ֵ�һ����Ҫ�������ʣ������ڸ��ƴ���ȱѪ��������ij�о�С�������һ�������������E�ĺϳ�·�ߣ�
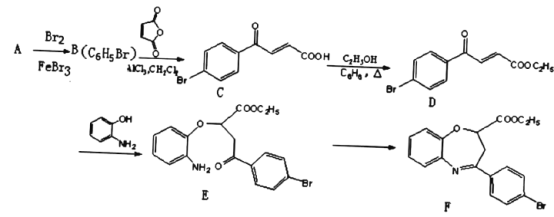
��1��A�Ľṹ��ʽΪ_____��C�й����ŵ�����Ϊ____��
��2��E��F����������Ӧ���䷴Ӧ��������Ϊ______��______��
��3��ͬʱ��������������D��һ��ͬ���칹��Ľṹ��ʽΪ______��
I.�������1��������
II.�ܷ���������Ӧ��
III.��������5�ֲ�ͬ��ѧ�������⡣
��4��1mol D������NaOH��Һ��Ӧʱ�������_____molNaOH��
��5����E�ϳ�Fʱ���������ɸ�����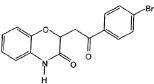 ��һ�ֳ������л���G��G�Ľṹ��ʽΪ_______��
��һ�ֳ������л���G��G�Ľṹ��ʽΪ_______��
��6����֪��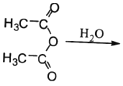 CH3COOH��ԭ��
CH3COOH��ԭ��![]() ��������������������������
��������������������������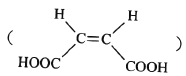 �������������
����������д����![]() Ϊԭ���Ʊ�������
Ϊԭ���Ʊ������� �ĺϳ�·������ͼ(���Լ�����)��______
�ĺϳ�·������ͼ(���Լ�����)��______
�ϳ�·������ͼʾ�����£�CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com