
【题目】一定温度和压强下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
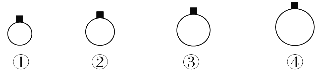
A. 气球②中装的是O2
B. 气球①和气球③中气体分子数相等
C. 气球③和气球④中气体密度之比为2∶1
D. 气球①和气球④中气体物质的量之比为4∶1
科目:高中化学 来源: 题型:
【题目】有机物R的分子式为C12H18,经测定数据表明,分子中除含苯环外不再含有其他环状结构,且苯环上只有两个侧链(分别是-C2H5和-C4H9),符合此条件的烃的结构有
A. 6种 B. 9种 C. 12种 D. 15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。
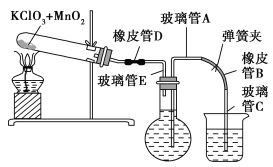
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。设计方案如下:
(1)用图甲装置(加持装置略)蒸馏并收集馏分SO2,实验时B中加入100.00mL葡萄酒样品和适量盐酸,加热使SO2全部逸出,在C中收集馏分。
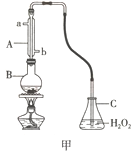
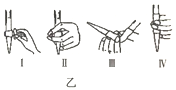
①若C中盛装H2O2溶液,则SO2与其完全反应的化学方程式为_________________________。除去C中过量的H2O2,然后用0.04000mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图乙中的_________(填序号)
②滴定至终点消耗NaOH溶液25.00mL,据此计算葡萄酒中SO2含量为____________g/L。
(2)由于蒸馏时盐酸易挥发,该测定结果比实际值偏高,因此改进实验方案时可将盐酸改为稀硫酸,或者采取以下措施:
①将图甲装置C中盛装的液体改为H2O,且馏分无挥发,改用0.01000 mol/L 标准I2溶液滴定,反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI,可选择________作指示剂,滴定终点的现象是_____________。
②盐酸虽然对此实验无干扰,但由于在上述实验过程中,存在空气的氧化作用,会使测定结果___________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原子可能处于同一平面
C. x的同分异构体只有y和z两种
D. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com