
32. (10分)已知A、B、C是单质,其中A是金属,各物质间的转化关系如图:
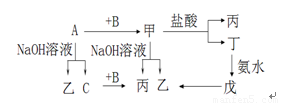
回答下列问题:(1)写出下列物质的化学式(各1分):
A:________、B:________、乙:________、
丙:________、丁:________、戊:________
(2)写出A与NaOH溶液的化学方程式 ;
写出丁生成戊的离子方程式 ;
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
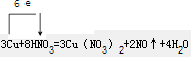

| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:








查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)C、D组成的常见化合物,其水溶液呈碱性,原因是_____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式______________________________。
(2)D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式_____________。
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_____________。
(4)
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的_______极;B极的电极反应式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com