
| A. | 向硫酸铜溶液中逐滴加入氨水至过量 | |
| B. | 向鸡蛋清溶液中逐滴加入饱和硫酸钠溶液至过量 | |
| C. | 向氢氧化铁胶体中逐滴加入盐酸至过量 | |
| D. | 向硫酸铝钾溶液中逐滴加入氢氧化钠溶液至过量 |
分析 A、向硫酸铜溶液中通入过量氨气,氨水多时生成四氨合铜离子,氨水少时生成氢氧化铜沉淀;
B、向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;
C、向氢氧化铁胶体中加入过量盐酸后先出现红褐色沉淀,后沉淀溶解;
D、向硫酸铝钾溶液中滴入氢氧化钠溶液至过量,先生成氢氧化铝白色沉淀,后氢氧化铝溶于氢氧化钠,所以沉淀消失.
解答 解:A、向硫酸铜溶液中通入过量氨气,先产生蓝色氢氧化铜沉淀,继续滴加,形成配合物四氨合铜离子使沉淀溶解,离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,后发生:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,所以能生成配合物,所以发生沉淀后溶解现象,故A不选;
B、向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出,无溶解的现象,故B选;
C、向氢氧化铁胶体中加入过量盐酸后先出现红褐色沉淀,后沉淀溶解,所以发生沉淀后溶解现象,故C不选;
D、向硫酸铝钾溶液中滴入氢氧化钠溶液至过量,先生成氢氧化铝白色沉淀,后氢氧化铝溶于氢氧化钠,所以沉淀消失,所以发生沉淀后溶解现象,故D不选;
故选B.
点评 本题考查铜、铝的化合物的性质,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | Y和Z可以组成元素质量比为7:16的化合物 | |
| B. | X和Y可以组成原子个数比分别为3:l和2:l的两种化合物 | |
| C. | 由X、Y、Z三种元素中任意两种组成的具有10电子的微粒多于2种 | |
| D. | X、Y、Z只能组成一种盐,其中X、Y、Z原子个数比为4:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移电子的数目为7.5 NA | |
| B. | 16.2 g纤维素完全燃烧,产生CO2分子的数目约为0.6 NA | |
| C. | 电解饱和食盐水产生11.2 L H2,则产生OH-的数目为0.1 NA | |
| D. | 1 L 0.1 mol•L-1NaHCO3溶液中含有HCO3-的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是 ( )
|
| X | Y |
Z | W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:填空题
某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体在标准状况下的体积为____________L;
(2)该气体在标准状况下的密度为__________g/L;
(3)该气体所含原子总数为____________个;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
Ⅰ.已知:Na2S2O3+H2SO4==Na2SO4+SO2↑+S ↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度 | Na2S2O3浓度[ | 稀硫酸 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。
(2)实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。
Ⅱ.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。如图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
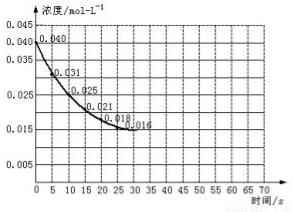
(3)前20秒内氧气的平均生成速率 mol/(L·s)
(4)在某温度下达到平衡时的平衡常数表达式是 。
(5)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是 ,NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)。
(6)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com