
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。

从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:

①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2 和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 100 |
c ( SO2 ) / ( mol L -1) | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 | 1 |
c ( O2 ) / ( mol L -1) | 5 | 3.5 | a | 1.75 | 1 | 0.5 | b | 0.5 | 0.5 |
c ( SO3 ) / ( mol L -1) | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 | 9 |
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2 和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题

①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中 Fe2+和 Fe3+的浓度恰好相等。则已反应的 Fe3+和未反应的 Fe3+的物质的量之比为:
A.4:3B.3:2C.2:3D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硅酸(H2SiF6)制备冰晶石(Na3AlF6)的工艺流程如图所示:
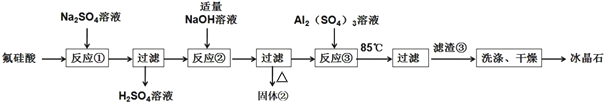
已知:冰晶石(Na3AlF6)微溶于水。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是_____。
(2)已知氟硅酸(H2SiF6)酸性强于硫酸,写出反应①的化学方程式______。
(3)反应②为脱硅工艺,固体②是_____。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为_____;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物_____。
(5)干燥前,检验冰晶石是否洗涤干净的实验方法是_____。
(6)从母液中可循环利用的物质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态碳原子的核外电子排布式为______。
(2)基态铬原子外围电子轨道表示式为___。
(3)卤族元素F、Cl的电负性由小到大的顺序是______。
(4)比较晶格能:MgO___MgS(用“>”、“<”)
(5)CO分子内σ键与π键个数之比为________。
(6)比较第一电离能:Mg___Al(用“>”、“<”)
(7)乙炔是________(填“非极性”或“极性”)分子。
(8)丙烯(CH3CH=CH2)分子中碳原子的杂化方式为________和________。
(9)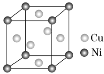 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+![]() O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
B.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
C.500℃下,将0.5mol I2(g)和0.5molH2(g)置于密闭的容器中充分反应生成HI(g),放热10kJ,其热化学方程式为:I2(g) + H2(g)![]() 2HI(g) △H = -20kJmol-1
2HI(g) △H = -20kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH-=HSO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种元素X、Y、Z、Q、T。X原子最外层M层上有2个未成对电子且无空轨道;Y原子的价电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2O3
B.T的一种单质的空间构型为正四面体形,键角为![]()
C.X和Q结合生成的化合物为共价化合物
D.ZO2是极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是( )

A.X是N2
B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的
C.NH4+中含有非极性共价键
D.上述历程的总反应为:2NH3+NO +NO2 2N2+3H2O
2N2+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com