
| A. | ls22s22p63s23p3 | B. | 1s22s22p3 | C. | 1s22s2sp4 | D. | 1s22s22p63s23p4 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
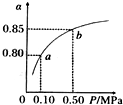 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 的NH4NO3溶液中含有的NO-3数目为0.3NA | |
| B. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA | |
| C. | 将标准状况下11.2L的Cl2通入足量水中,转移的电子总数为0.5NA | |
| D. | 一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | CaCO3溶于CH3COOH:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-═2Fe2++I2 | |
| D. | 向NaClO溶液中通入少量SO2:3ClO-+SO2+H2O═2HClO+SO42-+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu溶于稀硝酸:Cu+2H++NO3-═Cu2++NO2+H2O | |
| B. | NaAl02溶液中通入过量CO2气体:AlO2-+CO2+2H2O═Al(OH)3+HCO3- | |
| C. | 用CH3COOH溶解CaCO3:CaC03+2H+═Ca2++H2O+CO2 | |
| D. | NH4 HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com