
| A. | 该反应属于复分解反应 | |
| B. | 氧化性:KBrO3<KClO3 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 反应中若有1mol还原剂发生反应,则氧化剂得到10mol电子 |
分析 A、反应2KBrO3+Cl2═Br2+2KClO3是置换反应;
B、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性;
C、反应中氧化剂KBrO3与还原剂Cl2的物质的量之比为2:1;
D、在2KBrO3+Cl2═Br2+2KClO3中,1mol氯气参加反应转移10mol的电子.
解答 解:A、反应2KBrO3+Cl2═Br2+2KClO3是置换反应,而不是复分解,故A错误;
B、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,2KBrO3+Cl2═Br2+2KClO3中KBrO3是氧化剂,KClO3是氧化产物,所以氧化性KBrO3>KClO3,故B错误;
C、反应中氧化剂KBrO3与还原剂Cl2的物质的量之比为2:1,而不是1:2,故C错误;
D、在2KBrO3+Cl2═Br2+2KClO3中,1mol氯气参加反应转移10mol的电子,所以反应中若有1mol还原剂发生反应,则氧化剂得到10mol电子,故D正确;
故选D.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,注意氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,为易错点.


科目:高中化学 来源: 题型:选择题
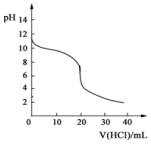 常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )| A. | 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| B. | V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3•H2O) | |
| C. | V(HCl)<20.00mL时,溶液一定呈碱性 | |
| D. | V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
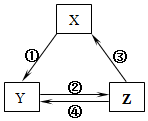 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| B | Na | Na2O2 | NaCl | ②加H2O |
| C | NO | NO2 | HNO3 | ③与C加热 |
| D | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度一定满足:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2难溶于水,属于非电解质 | |
| B. | Al2O3既能与强碱反应生成盐和水又能与酸反应生成盐和水,属于两性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | HCl气体溶于水电离出H+和Cl-,属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ③⑥⑦⑩ | C. | ①②③⑩ | D. | ①④⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com