
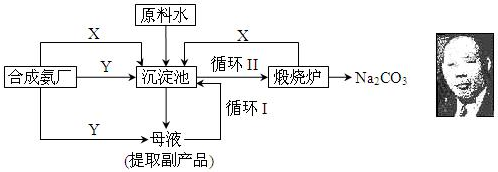
·ÖĪö £Ø1£©ŗĻ³É°±¹¤³§ŠčŅŖĻņÖĘ¼ī³§Ģį¹©Į½ÖÖŌĮĻĘųĢ壬ĖüĆĒ·Ö±šŹĒ¶žŃõ»ÆĢ¼ŗĶ°±Ęų£»¶žŃõ»ÆĢ¼ŌŚĖ®ČÜŅŗÖŠČܽā¶ČŠ”£¬°±ĘųŌŚĖ®ÖŠµÄČܽā¶Č“ó£¬ĻČĶØ°±ĘųŗóĶضžŃõ»ÆĢ¼£¬ÓŠĄūÓŚĢ¼ĖįĒāÄʵÄĪö³ö£»
£Ø2£©°±»ÆµÄ±„ŗĶĀČ»ÆÄĘČÜŅŗÖŠĶØČė¹żĮ涞Ńõ»ÆĢ¼£¬·¢Éś·“Ó¦¶žŃõ»ÆĢ¼ŗĶ°±Ė®·“Ӧɜ³ÉĢ¼ĖįĒāļ§£¬Ģ¼ĖįĒāļ§ŗĶĀČ»ÆÄĘ·“Ó¦£¬Éś³ÉĢ¼ĖįĒāÄĘ¾§ĢåĪö³ö£»
£Ø3£©Ģ¼ĖįĒāÄĘÄÜČÜÓŚĖ®£¬Īö³ö¾§ĢåŗóµÄČÜŅŗŅŖŃ»·ĄūÓĆ£¬“ÓÄøŅŗÖŠÓŠNH4ClæÉŅŌ×ö·ŹĮĻ£»
£Ø4£©ÅäÖĘČÜŅŗŠčŅŖČŻĮæĘ棬ĄūÓƵĪ¶ØÖÕµćŗĶ·ÓĢŖµÄ±äÉ«·¶Ī§·ÖĪöŃ”¼×»ł³Č¶ų²»Ń”·ÓĢŖ×÷ĪŖÖøŹ¾¼ĮµÄŌŅņ£»øł¾ŻŃĪĖįµÄĪļÖŹµÄĮææÉČ·¶ØĢ¼ĖįĒāÄʵÄÖŹĮ棬½ų¶ųæɼĘĖćÖŹĮæ·ÖŹż£®
½ā“š ½ā£ŗ£Ø1£©ŗĻ³É°±¹¤³§ŠčŅŖĻņÖĘ¼ī³§Ģį¹©Į½ÖÖŌĮĻĘųĢ壬ĖüĆĒ·Ö±šŹĒ¶žŃõ»ÆĢ¼ŗĶ°±Ęų£¬¶žŃõ»ÆĢ¼ŌŚĖ®ČÜŅŗÖŠČܽā¶ČŠ”£¬Éś³ÉĢ¼ĖįĒāÄĘÉŁ£¬²»ÄÜĪö³ö¾§Ģ壬¶ų°±ĘųŌŚĖ®ÖŠµÄČܽā¶Č“ó£¬ĻČĶØ°±ĘųŗóĶضžŃõ»ÆĢ¼²śÉśĢ¼ĖįĒāļ§¶ą£¬ÓŠĄūÓŚĢ¼ĖįĒāÄʵÄĪö³ö£¬
¹Ź“š°øĪŖ£ŗCO2”¢NH3£»°±ĘųŌŚĖ®ÖŠČܽā¶Č“ó£¬ĻČĶØ°±ĘųŹ¹ČÜŅŗ³Ź¼īŠŌæÉŅŌČܽāøü¶ą¶žŃõ»ÆĢ¼£¬Éś³ÉĢ¼ĖįĒāļ§£¬ÓŠĄūÓŚĢ¼ĖįĒāÄĘĪö³ö£»
£Ø2£©°±»ÆµÄ±„ŗĶĀČ»ÆÄĘČÜŅŗÖŠĶØČė¹żĮ涞Ńõ»ÆĢ¼£¬·¢Éś·“Ó¦¶žŃõ»ÆĢ¼ŗĶ°±Ė®·“Ӧɜ³ÉĢ¼ĖįĒāļ§£¬Ģ¼ĖįĒāļ§ŗĶĀČ»ÆÄĘ·“Ó¦£¬ÓÉÓŚĢ¼ĖįĒāÄĘČܽā¶ČŠ”£¬ĖłŅŌĻČÉś³ÉĢ¼ĖįĒāÄĘ¾§ĢåĪö³ö£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗNaCl+CO2+NH3+H2O=NaHCO3”ż+NH4Cl£¬
¹Ź“š°øĪŖ£ŗNaCl+CO2+NH3+H2O=NaHCO3”ż+NH4Cl£»
£Ø3£©Ģ¼ĖįĒāÄĘÄÜČÜÓŚĖ®£¬Īö³ö¾§ĢåŗóµÄČÜŅŗÖŠ»¹ŗ¬ÓŠ½Ļ¶ąĢ¼ĖįĒāÄĘ£¬ĖłŅŌŅŖŃ»·ĄūÓĆ£¬“ÓÄøŅŗÖŠÓŠNH4ClæÉŅŌ×ö·ŹĮĻ£¬
¹Ź“š°øĪŖ£ŗŃ»·¢ń£»×ö·ŹĮĻ£»
£Ø4£©Åä³É250mlNaHCO3ČÜŅŗ£¬ÓƵ½µÄŅĒĘ÷ÓŠµē×ÓĢģĘ½”¢ÉÕ±”¢²£Į§°ō”¢250mLČŻĮæĘ攢½ŗĶ·µĪ¹Ü£¬ĖłŅŌĖłŠčµÄ¶ØĮæŅĒĘ÷³żµĪ¶Ø¹ÜĶā£¬»¹ÓŠµē×ÓĢģĘ½”¢250mlČŻĮæĘ棻Ģ¼ĖįĒāÄĘČÜŅŗµÄpH±¾Ą“¾Ķ½Ó½ü8.2£¬Óė·ÓĢŖ±äÉ«µÄpH½Ó½ü£¬±äÉ«Ź±µÄpHŗĶ·“Ó¦ÖÕµćµÄpH²»ŗĆÅŠ¶Ļ£»¶ųŹ¹ÓĆ¼×»ł³ČČŻŅ×ÅŠ¶ĻÖÕµć£¬ĒŅ·“Ó¦²śÉśµÄ¶žŃõ»ÆĢ¼²»ÄÜČ«²æŅŻ³öŹ¹ČÜŅŗĘ«ĖįŠŌ£¬Ņņ“ĖŹ¹ÓĆ¼×»ł³ČµÄĪó²īŠ”£ØŹ¹ÓĆ¼×»ł³ČŅ×ÅŠ¶ĻµĪ¶ØÖÕµć£¬Īó²īŠ”£©£¬
ĻūŗÄŃĪĖįµÄĪļÖŹµÄĮæn£ØHCl£©=0.0215L”Į0.1000mol/L=0.00215mol£¬
Ōņ25mLČÜŅŗÖŠn£ØNaHCO3£©=0.00215mol£¬
ĖłŅŌѳʷ֊m£ØNaHCO3£©=0.00215mol”Į10”Į84g/mol=1.806g£¬
¦Ų£ØNaHCO3£©=$\frac{1.806g}{1.840g}$=98.2%=0.982£¬
¹Ź“š°øĪŖ£ŗµē×ÓĢģĘ½”¢250mLČŻĮæĘæ£»Ń”ÓĆ·ÓĢŖ×÷ĪŖÖøŹ¾¼Į£¬²»ÄÜČ·¶ØµĪ¶ØÖÕµć£»0.982£®
µćĘĄ ±¾Ģāæ¼²éĮĖ“æ¼ī¹¤ŅµÖʱøŌĄķ£¬·“Ó¦ŹµÖŹµÄÓ¦ÓĆ£¬ŹŌ¼ĮµÄ×÷ÓĆ£¬Ąķ½āÉś²śŌĄķŗĶ¹ż³ĢµÄŹµÖŹŹĒ½ā“šµÄ¹Ų¼ü£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦”¢ŹµŃéÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆČÜŅŗµÄPH=4 | |
| B£® | ÉżøßĪĀ¶Č£¬ČÜŅŗµÄPHŌö“ó | |
| C£® | Ļ”ŹĶŹ±ČÜŅŗÖŠĖłÓŠĄė×ÓµÄÅØ¶Č¶¼¼õÉŁ | |
| D£® | “ĖĖįµÄµēĄėĘ½ŗā³£ŹżŌ¼ĪŖ1”Į10-9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 7.5mol | B£® | 1.5mol | C£® | 3mol | D£® | 3.25mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 25”ꏱ£¬ŅŃÖŖAgClµÄKsp=1.8”Į10-10£¬Ag2CO3ŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
25”ꏱ£¬ŅŃÖŖAgClµÄKsp=1.8”Į10-10£¬Ag2CO3ŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | Ag2CO3µÄKspĪŖ8.1”Į10-12 | |
| B£® | Ag2CO3£Øs£©+2Cl-£Øaq£©?2AgCl£Øs£©+CO32-£Øaq£©Ę½ŗā³£ŹżK=2.5”Į108 | |
| C£® | ŌŚAg2CO3µÄ±„ŗĶČÜŅŗÖŠ¼ÓČėK2CO3£Øs£©æÉŹ¹c£ØCO32-£©Ōö“ó£ØÓÉYµćµ½Zµć£© | |
| D£® | ŌŚ0.001mol•L-1AgNO3ČÜŅŗÖŠµĪČėĶ¬ÅØ¶ČµÄKClŗĶK2CO3µÄ»ģŗĻČÜŅŗ£¬CO32-ĻČ³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
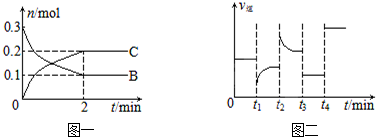
| A£® | t2Ź±øıäµÄĢõ¼žæÉÄÜŹĒŌö“óc£ØC£©£¬Ę½ŗāŹ±BµÄĪļÖŹµÄĮæ·ÖŹżŌö“ó | |
| B£® | t1Ź±øıäµÄĢõ¼žŹĒ½µĪĀ£¬Ę½ŗāÄęĻņŅĘ¶Æ | |
| C£® | t3Ź±æÉÄÜŹĒ¼õŠ”Ń¹Ēæ£¬Ę½ŗā²»ŅĘ¶Æ£»t4Ź±æÉÄÜŹĒŹ¹ÓĆ“ß»Æ¼Į£¬c£ØB£©²»±ä | |
| D£® | x=2£¬·“Ó¦æŖŹ¼2 minÄŚ£¬v£ØB£©=0.1 mol/£ØL•min£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
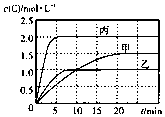 Ļņ¼×”¢ŅŅ”¢±ūČżøöĆܱÕČŻĘ÷ÖŠ³äČėŅ»¶ØĮæµÄAŗĶB£¬·¢Éś·“Ó¦£ŗxA£Øg£©+B£Øg£©?2C£Øg£©£®ø÷ČŻĘ÷µÄ·“Ó¦ĪĀ¶Č”¢·“Ó¦ĪļĘšŹ¼Į棬·“Ó¦¹ż³ĢÖŠCµÄÅضČĖꏱ¼ä±ä»Æ¹ŲĻµ·Ö±šŅŌ±ķŗĶĶ¼±ķŹ¾
Ļņ¼×”¢ŅŅ”¢±ūČżøöĆܱÕČŻĘ÷ÖŠ³äČėŅ»¶ØĮæµÄAŗĶB£¬·¢Éś·“Ó¦£ŗxA£Øg£©+B£Øg£©?2C£Øg£©£®ø÷ČŻĘ÷µÄ·“Ó¦ĪĀ¶Č”¢·“Ó¦ĪļĘšŹ¼Į棬·“Ó¦¹ż³ĢÖŠCµÄÅضČĖꏱ¼ä±ä»Æ¹ŲĻµ·Ö±šŅŌ±ķŗĶĶ¼±ķŹ¾| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| ČŻ»ż | 0.5L | 0.5L | 1.0L |
| ĪĀ¶Č/”ę | T1 | T2 | T2 |
| ·“Ó¦Īļ ĘšŹ¼Įæ | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
| A£® | ČōĘ½ŗāŹ±ĪĀ¶Č²»±ä£¬øıäČŻĘ÷Ģå»żĘ½ŗā²»ŅĘ¶Æ | |
| B£® | ÓÉĶ¼æÉÖŖ£ŗT1£¼T2£¬ĒŅøĆ·“Ó¦ĪŖĪüČČ·“Ó¦ | |
| C£® | l0minÄŚ¼×ČŻĘ÷ÖŠ·“Ó¦µÄĘ½¾łĖŁĀŹv£ØA£©=0.025mol•£ØL•min£©-1 | |
| D£® | T1”ę£¬ĘšŹ¼Ź±¼×ČŻĘ÷ÖŠ³äČė0.5molA”¢1.5molB£¬Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ25% |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com