
 WI2(g)
WI2(g)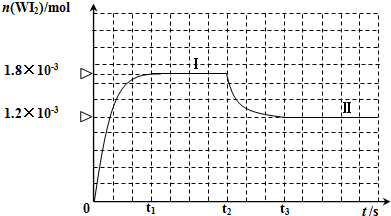
| △n |
| V△t |
| 1.8×10-3mol |
| 0.05L×3min |
| 0.508g |
| 254g/mol |
| 1.80×10-3mol |
| 0.05L |
| 0.0002mol |
| 0.05L |
| 0.036mol/L |
| 0.004mol/l |


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
 WI2(g)
WI2(g)| C(WI2) |
| C(I2) |
| C(WI2) |
| C(I2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南株洲市南方中学高二上学期期末考试理科化学试卷(带解析) 题型:填空题
(12分)(每空3分)碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g) WI2(g)ΔH<0
WI2(g)ΔH<0
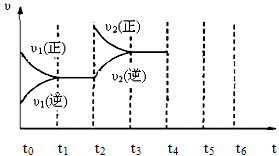
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为 。
(2)能够说明上述反应已经达到平衡状态的有 。
| A.I2与WI2的浓度相等 |
| B.容器内气体压强不再变化 |
| C.W的质量不再变化 |
| D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com