
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 | |
| D. | 电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4:1 |
分析 A.根据离子放电顺序可知,实质是电解水,溶液体积减小;
B.电解稀氢氧化钠溶液,实质上是电解水,NaOH物质的量不变,而溶液体积减小;
C.电解硫酸钠溶液,实质是电解水,电池总反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阴极析出氢气,阳极析出氧气;
D.电解硝酸银溶液,阳极电极反应式:4OH--4e-=2H2O+O2↑,阴极首先发生反应:4Ag++4e-=4Ag,Ag+放电完毕,会发生反应:4H++4e-=2H2↑,结合电子转移守恒判断.
解答 解:A.根据离子放电顺序可知,电解稀硫酸溶液实质是电解水,溶液体积减小,硫酸的物质的量不变,则溶液中c(H+)增大,故A错误;
B.电解稀氢氧化钠溶液,实质上是电解水,NaOH物质的量不变,而溶液体积减小,则溶液中c(OH-)增大,故B错误;
C.电解硫酸钠溶液,实质是电解水,电池总反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阴极析出氢气,阳极析出氧气,在阴极上和阳极上析出的产物的物质的量之比为2:1,故C错误;
D.电解硝酸银溶液,阳极电极反应式:4OH--4e-=2H2O+O2↑,阴极首先发生反应:4Ag++4e-=4Ag,Ag+放电完毕,会发生反应:4H++4e-=2H2↑,当阴极有H+放电时,在阴极上和阳极上析出的产物的物质的量之比不是4:1,故D正确,
故选:D.
点评 本题考查电解原理,关键是理解掌握了电解时溶液中离子的放电顺序,理解掌握电解类型:①电解水型、②电解电解质型、③放氧生酸型、④放氢生碱型.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
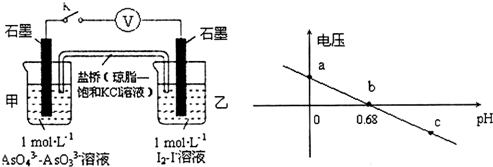
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
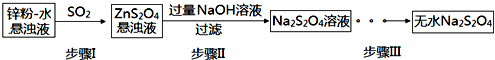
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com