
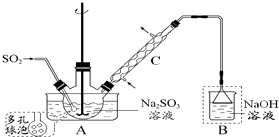
 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:分析 (1)根据装置图可知仪器名称;
(2)多孔球泡可增大气体和液体的接触面积;装置B 是尾气吸收装置,倒置的漏斗可以防倒吸;
(3)①搅拌可以防止Zn(OH)2 覆盖在锌粉表面;
②根据次硫酸氢钠甲醛的分解温度应选择水浴加热,水浴加热均匀,且容易控制;
③过滤的目的是除去锌粉和生成的氢氧化锌,同时要防止次硫酸氢钠甲醛从溶液中析出;
(4)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化;次硫酸氢钠甲醛易溶于水,微溶于乙醇,加入乙醇可以降低次硫酸氢钠甲醛溶解度.
解答 解:(1)根据装置图可知仪器C的名称为冷凝管,
故答案为:冷凝管;
(2)多孔球泡可增大二氧化硫气体和Na2SO3液体的接触面积,加快反应速度,装置B 是尾气吸收装置,倒置的漏斗可以防倒吸,所以装置B 的作用是吸收未反应的二氧化硫,防止污染空气并阻止空气进入装置A,
故答案为:增大二氧化硫气体和Na2SO3液体的接触面积,加快反应速度;吸收未反应的二氧化硫,防止污染空气并阻止空气进入装置A;
(3)①防止Zn(OH)2 覆盖在锌粉表面阻止反应进行,可以通过搅拌的方法,
故答案为:搅拌;
②根据次硫酸氢钠甲醛的分解温度应选择水浴加热,水浴加热均匀,且容易控制,
故答案为:水浴加热;
③过滤的目的是除去锌粉和生成的氢氧化锌,同时要防止次硫酸氢钠甲醛从溶液中析出,所以要趁热过滤,
故答案为:除去多余的锌粉和生成的氢氧化锌,防止硫酸氢钠甲醛冷却结晶,造成损失;
(4)次硫酸氢钠甲醛具有还原性,在敞口容器中蒸发浓缩,可以被空气中的氧气氧化变质,次硫酸氢钠甲醛易溶于水,微溶于乙醇,加入乙醇可以降低次硫酸氢钠甲醛溶解度,所以步骤3的②中加入乙醇,有晶体析出的原因是加入乙醇降低了次硫酸氢钠甲醛的溶解度,从而析出晶体,
故答案为:防止产物被空气氧化;加入乙醇降低了次硫酸氢钠甲醛的溶解度,从而析出晶体.
点评 本题考查了实验制备方案的设计,实验步骤的操作,仪器使用方法,反应过程中的物质判断,题目难度中等.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:解答题
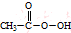 (过氧乙酸)+H2O
(过氧乙酸)+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉撒入稀硫酸中2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O | |
| C. | 把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ | |
| D. | 用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com