
常温下,下列各组离子在溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一
B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一
C.pH=12的溶液: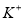 、
、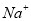 、
、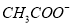 、Br-
、Br-
D.由水电离产生的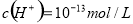 的溶液:
的溶液: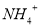 、
、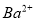 、
、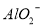 、
、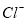
C
【解析】
试题分析:A. NO3-、H+、Fe2+会发生氧化还原反应而不能大量共存,错误;B.与铝反应产生大量氢气的溶液在碱性溶液中OH-、HCO3—会发生反应而不能大量共存,在酸性溶液中H+、NO3一不会产生氢气,而且H+、HCO3—会发生反应而不能大量共存,错误;C. pH=12的溶液是溶液:K+、Na+、CH3COO-、Br-不会发生任何反应,可以大量存在,错误;D. 由水电离产生的c(H+)=10-13mol/L的溶液可能是酸性,也可能是碱性,在酸性溶液中AlO2-会发生反应不能大量共存;在碱性溶液中NH4+会发生离子反应而不能大量共存,错误。
考点:考查离子大量共存的知识。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:填空题
(11分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。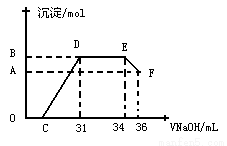 试回答下列问题:
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式_______________ ;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:填空题
(8分).已知化合物A的分子式为C4H6O2,不溶于水,并可以发生如下图所示的变化:
已知:C物质的一氯代物D只有两种同分异构体。请回答:
(1)A分子中含有的官能团的名称 。
(2)②属于 反应(反应类型)
(3)写出②的反应方程式 。
(4)写出C的同分异构体中属于酯且能发生银镜反应的结构简式
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓+2HClO
B.NH4HSO3溶液与足量NaOH溶液共热:NH +H++2OH-==NH3↑+2H2O
+H++2OH-==NH3↑+2H2O
C. 向1L 1mol/L碘化亚铁溶液中通入标准状况下22.4L氯气:2Fe2+-+Cl2=2Fe3+2Cl-
D.澄清石灰水与少量的小苏打溶液混合:Ca2+ + OH-+ HCO3- CaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(11分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
①铝土矿的主要成分是Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如图1所示:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图2所示:
回答下列问题:
(1)写出反应1的化学方程式_____________、_______ ___;
(2)滤液Ⅰ中加入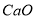 生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。
生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。
(3)E常用作制作豆腐的添加剂,化合物C是____,写出由D制备冰晶石的化学方程式______________;
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质。下列说法错误的是
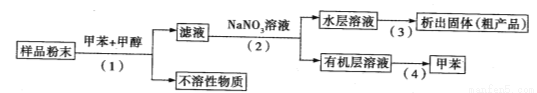
A.步骤(1)需要过滤装置 B.活性物质易溶于有机溶剂,难溶于水
C.步骤(3)需要用到蒸发皿 D.步骤(4)是利用物质的沸点差异进行分离的
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2和水反应时,每产生1 mol O2转移电子4 mol
C.CaO2中阴阳离子的个数比为1:1
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2 =2Ca CO3+O2
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列判断中一定正确的是:
A.等物质的量的CaCl2及CaO2固体中阴、阳离子数之比均为2∶1
B.等质量的O2与O3中,氧原子的个数比为3∶2
C.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶2
D.10mL 0.3mol·L-1NaCl与30mL0.1mol·L-1AlCl3溶液中Cl-物质的量浓度比为1∶3
查看答案和解析>>
科目:高中化学 来源:[同步]2015年课时练(鲁科版必修2)课时6元素周期表、元素周期律(解析版) 题型:选择题
砹是原子序数最大的卤族元素,推测砹的化合物不可能具有的性质是( )
A.砹是有色固体 B.砹化氢很稳定
C.砹易溶于有机溶剂 D.砹化银不溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com