
某同学设计如图装置,研究非金属元素性质变化规律。
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl===NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_________________________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。
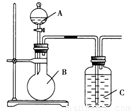
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;
证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。
(1)硝酸溶液 碳酸钙 硅酸钠溶液 产生白色沉淀
CO2+SiO32-+H2O===H2SiO3↓+CO32-
(2)淀粉-KI溶液 溶液变蓝色 2I-+Cl2===I2+2Cl-
增加装有氢氧化钠溶液的尾气吸收装置
(3)Cl2+H2S=== S↓+2HCl 强
【解析】(1)根据较强的酸制取较弱的酸可知,A中装试剂是硝酸溶液,B中装试剂是碳酸钙,C中装试剂硅酸钠溶液。由于碳酸的酸性强于硅酸的,所以C中有白色沉淀硅酸生成,反应的方程式是CO2+SiO32-+H2O===H2SiO3↓+CO32-。
(2)酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以C中试剂是淀粉碘化钾溶液。由于氯气能把碘化钾氧化生成单质碘,所以实验现象是溶液变蓝色,反应的离子方程式是2I-+Cl2===I2+2Cl-;由于氯气有毒,所以必须增加装有氢氧化钠溶液的尾气吸收装置。
(3)高锰酸钾溶液能把盐酸氧化生成氯气,而氯气能把硫化氢氧化生成单质S沉淀,所以反应的方程式是Cl2+H2S=== S↓+2HCl,这说明氯的非金属性比硫的非金属性强。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题:| FeBr3 |
| FeBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
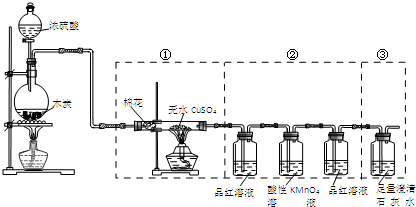
| A、实验时可观察到装置①中白色硫酸铜粉末变蓝色 | B、装置②中两次用到品红溶液的作用相同 | C、装置③用于检验产物中二氧化碳气体的生成 | D、如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省东北育才学校高三第一次模拟考试化学试卷(带解析) 题型:实验题
某同学设计如图装置,研究非金属元素性质变化规律。
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl===NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_________________________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。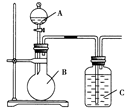
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;
证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com