
����Ŀ��CuCl��CuCl2������Ҫ�Ļ���ԭ�ϣ����������������ϡ����������������ȡ�
��֪����CuCl������CuCl2���ʵ��Ļ�ԭ����SO2��SnCl2�Ȼ�ԭ�Ƶã�
2Cu2����2Cl����SO2��2H2O![]() 2CuCl����4H����SO42-
2CuCl����4H����SO42-
2CuCl2��SnCl2=2CuCl����SnCl4
��CuCl2��Һ���Ҷ���(H2N��CH2��CH2��NH2)���γ������ӣ�
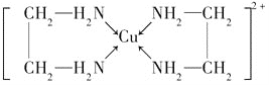
��ش��������⣺
(1)��̬Cuԭ�ӵĺ�������Ų�ʽΪ_________��H��N��O����Ԫ�صĵ縺���ɴ�С��˳����_____________
(2)SO2���ӵĿռ乹��Ϊ_____________
(3)�Ҷ��������е�ԭ�ӹ�����ӻ�����Ϊ_________�Ҷ��������װ�[N(CH3)3]�����ڰ������Ҷ��������װ��ķе�ߵö࣬ԭ����_____________
(4)�������γɵ��������к��еĻ�ѧ��������______(����ĸ)��
A.��λ�� B.���Լ� C.���Ӽ� D.�Ǽ��Լ�
���𰸡�1s22s22p63s23p63d104s1��[Ar]3d104s1 O��N��H V�� sp3�ӻ� �Ҷ������Ӽ����γ���������װ�����֮�䲻���γ���� ABD
��������
(1)����ͭ��ԭ������Ϊ29������������ԭ����д��̬ԭ�ӵĵ����Ų�ʽ�����ݵ縺�Եı仯���ɱȽϵ縺�Դ�С��
(2)�����ж�SO2���Ӻ��е������Լ��µ��Ӷ����жϿռ乹�ͣ�
(3)���ݼ۲���Ӷ����ж��Ҷ��������е�ԭ�ӵ��ӻ����ͣ������Ƿ���������������۷е�ߵͲ�ͬ��ԭ��
(4)���ݳɼ�ԭ�ӵ��ص��жϻ�ѧ�����͡�
(1)ͭ��ԭ������Ϊ29�������������ԭ����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1����Ԫ�����ڱ���ͬһ���ڴ�����Ԫ�صĵ縺������ǿ��ͬһ������ϵ���Ԫ�صĵ縺����������֪�縺��ǿ��˳��ΪO��N��H��
(2)SO2�����к���2���������µ��Ӷ���=![]() =1�����Է���ΪV�Σ�
=1�����Է���ΪV�Σ�
(3)�Ҷ��������е�ԭ���γ�4���������۲���Ӷ���Ϊ4����ԭ��Ϊsp3�ӻ����Ҷ������Ӽ�����γ���������ʵ��۷е�ϸߣ������װ����Ӽ䲻���γ�������۷е�ϵͣ�
(4)�������γɵ��������к��еĻ�ѧ����N��Cu֮��Ϊ��λ����C-C��Ϊ�Ǽ��Լ���C-N��N-H��C-H��Ϊ���Լ����������Ӽ����ʴ�Ϊ��ABD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ���ǣ� ��
���ܷ���������Ӧ����һ��������
����֬ˮ���õ��Ĵ��DZ�����
����Ȼ������ˮ����������Ƕ�������������
�ܵ��ۡ���ά�ء����ࡢ��֬���Ǹ߷��ӻ�����
�ݵ�������Һ�м���K2SO4��Һ�����ʴ���Һ�����������ֱ仯�б���
A.�٢ڢ�B.�ۢ�C.�ڢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������߷ֱ��ʾԪ�ص�ij��������˵�����Ĺ�ϵ![]() Ϊ�˵������YΪԪ�ص��й�����
Ϊ�˵������YΪԪ�ص��й�����![]() ��������Ԫ���йص�������������߱��������Ӧ�ĺ����У�
��������Ԫ���йص�������������߱��������Ӧ�ĺ����У�

(1)��VIA��Ԫ�ص������������� ______
(2)��������Ԫ�ص�����ϼ��� ______
(3)![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �����Ӱ뾶�� ______ ��
�����Ӱ뾶�� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ԫ�ص����ӣ�![]() ��
��![]() ��
��![]() ��
��![]() ��������ͬ�ĵ��Ӳ�ṹ��������������ȷ����
��������ͬ�ĵ��Ӳ�ṹ��������������ȷ����
A. ԭ�Ӱ뾶A>B>D>C B. ԭ������D>C>B>A
C. ���Ӱ뾶C>D>B>A D. ���ʵĻ�ԭ��A>B>D>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڲ�ͬ�ķ�Ӧ�У����Էֱ���ֳ����ԡ������Ժͻ�ԭ�ԡ����������ĸ���Ӧ����д��������������Ӧ�У��ֱ����ʲô���ʣ�
��Zn��2HCl=ZnCl2��H2��________��
��NaOH��HCl=NaCl��H2O________��
��2HCl![]() H2����Cl2��________��
H2����Cl2��________��
��KClO3��6HCl(Ũ)=3Cl2����KCl��3H2O________������ʽ���������뻹ԭ�������ʵ���֮��Ϊ________������5mol��ԭ���������������ɵ�Cl2Ϊ________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ˮ��Һ��ֻ���ܺ������������е������֣�K����NH4����Cl-��Mg2����Ba2����CO32-��SO42-����ȡ���ݸ�100mL��Һ��������ʵ�飺
��һ�ݼ���AgNO3��Һ�г����������ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ���0.08mol���塣�����ݼ�����BaCl2��Һ�õ��������12.54g������������ϴ�ӡ������������Ϊ4.66g��
��������ʵ�飬�ش��������⣺
��1���ɵ�һ�ݽ��е�ʵ���ƶϸû�����Ƿ�һ������Cl-��__��
��2���ɵڶ��ݽ��е�ʵ���֪�������Ӧ����__�������ʵ���Ũ��Ϊ__��
��3���ɵ����ݽ��е�ʵ���֪12.54g�����ijɷּ����ʵ�����__��
��4���ۺ�����ʵ�飬����Ϊ���½�����ȷ����__��
A.�û��Һ��һ������K����NH4��![]() ��CO32-��SO42-�����ܺ�Cl-����n(K��)��0.04mol
��CO32-��SO42-�����ܺ�Cl-����n(K��)��0.04mol
B.�û��Һ��һ������NH4����CO32-��SO42-�����ܺ�K����Cl-
C.�û��Һ��һ������NH4����CO32-��SO42-�����ܺ�Mg2����K����Cl-
D.�û��Һ��һ������NH4����SO42-�����ܺ�Mg2����K����Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��(NaAlH4)���л��ϳɵ���Ҫ��ԭ������ϳ���·��ͼ��ʾ��

(1)��֪��ˮAlCl3�ڳ�ʪ�Ŀ����м���ˮ�⡣ijʵ��С������ͼ�в���װ���Ʊ���ˮAlCl3��
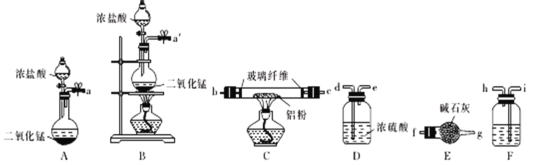
��ʵ��С���ʵ��װ�ã��������������Ӹ������ӿڣ�˳��Ϊ��__��fg��
��װ��E��������__��װ��F��Ӧʢװ���Լ���__
(2)AlCl3��NaH��Ӧʱ���轫AlCl3�����л��ܼ����ٽ��õ�����Һ�μӵ�NaH��ĩ�ϣ��˷�Ӧ��NaH��ת���ʽϵ͵Ŀ���ԭ����__
(3)�������⻯����ˮ��Ӧ���ɵ�����������ⶨ���⻯����Ʒ���ȡ�
���䷴Ӧ�Ļ�ѧ����ʽΪ__
���������ͼ����װ�òⶨ���⻯����Ʒ�Ĵ���(�������ʲ����뷴Ӧ)��
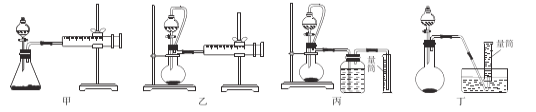
�Ӽ�Լ�ԡ�ȷ�Կ��ǣ������˵ķ�����__(����)
��ȡ��Ʒag����ʵ�������������ΪVmL(��״̬)�������⻯����Ʒ����Ϊ__(�ô���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ���ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼװ����һ�������N��C��Si�ķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�����û���Ӧ�Ĺ��ɣ�������ͼװ�������OԪ�صķǽ����Ա�Sǿ��ʵ���о���
�ش��������⣺
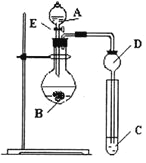
��1��ͼ��Dװ�������� ��
��2������������������ѡ����ͬѧ��Ƶ�ʵ�����õ����ʣ�
��ϡHNO3��Һ��ϡ������̼�����Na2SiO3��Һ��SiO2
�Լ�AΪ_________���Լ�CΪ_________(�����)��
��3����ͬѧ��Ƶ�ʵ�����õ��Լ�AΪ________���Լ�CΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����C��C����Ȳ�������������ӳɷ�Ӧ��IJ���Ľṹ��ʽ��ͼ��ʾ����Ȳ�����ܵĽṹ�У� ��
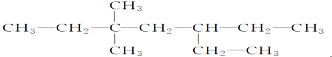
A.1��B.2��C.3��D.4��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com