
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: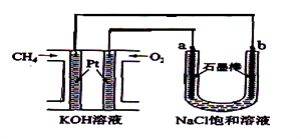
(1)甲烷燃料电池负极的电极反应为:。
(2)b电极上得到的气体是 , 电解氯化钠溶液的总反应方程式为 。
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:负极。
【答案】
(1)CH4-8e-+10OH-=CO32-+7H2O
(2)H2,2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)4L
(4)CH3OH+8OH--6e-=CO32-+6H2O
【解析】(1).甲烷在碱性条件下失去电子生成碳酸根离子和水,电极反应为: CH4-8e-+10OH-=CO32-+7H2O;
(2). B极连接甲烷,则为阴极,溶液中的氢离子放电生成氢气,电解氯化钠溶液生成氢氧化钠和氢气和氯气,所以答案是:H2;2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3). 通入1L甲烷,其物质的量为1/22.4mol,则失去的电子数为8/22.4mol,根据电荷守恒分析,最多产生的氯气为4/22.4mol,则标况下的体积为4L;
(4).甲醇在碱性条件下失去电子结合氢氧根离子,生成碳酸根离子和水,电极反应为: CH3OH+8OH--6e-=CO32-+6H2O。


科目:高中化学 来源: 题型:
【题目】乙醇可以发生下列化学反应,在反应里乙醇分子断裂碳氧键而失去羟基的是
A. 乙醇与金属钠反应 B. 乙醇与氢卤酸的取代反应
C. 乙醇的催化氧化反应 D. 乙醇和乙酸的酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是( )

A. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
B. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗 1molNa2O2,转移电子数为NA
C. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解化学方程式或水解离子方程式正确的是: ( )
A.CH3COO- + H2O ![]() CH3COOH + OH-
CH3COOH + OH-
B.NH4+ + H2O=NH4OH + H+
C.CH3COOH + NaOH ![]() CH3COONa + H2O
CH3COONa + H2O
D.NaCl + H2O ![]() NaOH + HCl
NaOH + HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 分子式符合C5H11Cl的化合物有6种
C. 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3
D. 菲的结构简式为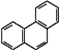 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量相同的铁单质与下列条件下相同体积的硫酸反应时,生成氢气速率最快的是( )
A.20℃铁片 1mol/L硫酸
B.30℃铁粉 1mol/L硫酸
C.30℃铁粉 2mol/L硫酸
D.30℃铁片 18mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ______。
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y均为惰性电极,则: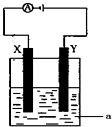
①若a为CuSO4溶液,则电解时的化学反应方程式为 .通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com