
科目:高中化学 来源:不详 题型:计算题
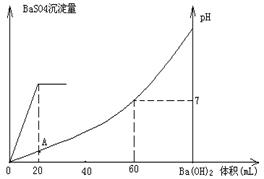
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10-2 mol/L | B.10-12 mol/L | C.2×10-12 mol/L | D.0.02mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml | |
 H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H="–1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=–269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01mol/L | B.0.017mol/L | C.0.05mol/L | D.0.50mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol/L氨水中:c(NH4+) + c(H+) = c(OH-) |
| B.0.1 mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-) |
| C.同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+) + 2c(NH3·H2O) = 2c(SO42-) |
| D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-) = c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将②溶液用蒸馏水稀释,使体积扩大10倍,所得溶液pH变为(a-1) |
| B.V1L③溶液和V2L④溶液混合,若混合后溶液pH=3,则V1:V2=11:9 |
| C.①与④两溶液等体积混合,混合液pH=7 |
| D.①与③两溶液的物质的量浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com