
【题目】相同温度、相同浓度的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是
![]()
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
【答案】B
【解析】
A.等浓度的NH4Cl、(NH4)2SO4溶液,NH4Cl溶液中铵根离子的浓度小于(NH4)2SO4溶液,铵根离子的浓度越大,溶液的酸性越强,则(NH4)2SO4溶液的酸性比NH4Cl溶液强,pH更小,故A错误;
B.(NH4)2SO4中铵根离子的浓度大于NH4Cl的,水解程度大,酸性强,CH3COONa是强碱弱酸盐,溶液呈碱性,但醋酸的酸性强于碳酸,则醋酸根离子水解程度小于碳酸根离子,CH3COONa溶液的pH小于相同浓度的Na2CO3溶液,符合图中顺序,故B正确;
C.氢氧化钠是强碱,其碱性强于相同浓度的碳酸钠溶液,故C错误;
D.(NH4)2SO4是强酸弱碱盐,其溶液呈酸性,其pH不可能比碳酸钠溶液大,故D错误;
答案选B。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】碘及其化合物在人类活动中占有重要地位。已知反应H2(g) + I2(g)![]() 2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
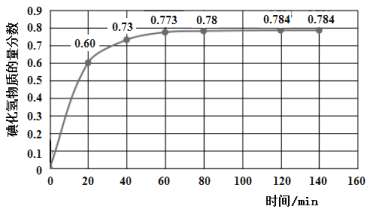
(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率![]() (HI)=_____kPa·min-1(用含p的式子表示)。
(HI)=_____kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率α(H2)=____________。
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,![]() ________(填“增大”“减小”或“不变”)。
________(填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是__________。
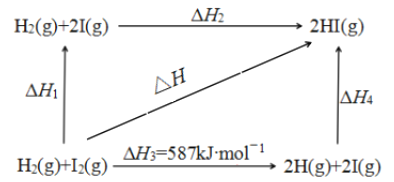
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=________kJmol-1
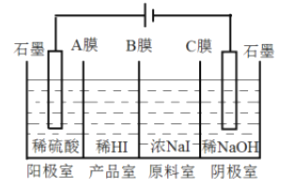
(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为______________。
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为______膜,C膜为______膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定容积的密闭容器中进行反应;N2(g)+3H2(g)![]() 2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
A. N2为0.2mol/L;H2为0.6mol/L B. N2为0.15mol/L
C. N2、H2均为0.18 mol/L D. NH3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
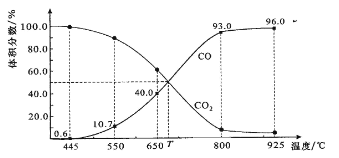
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4g氢氧化钠和mg碳酸钠混合并配成溶液,向溶液中滴加一定浓度的稀盐酸,加入盐酸的体积和生成二氧化碳的质量的关系如图所示,回答下列问题:(不考虑二氧化碳的溶解)
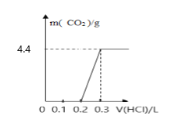
(1)加入盐酸的体积为0.2L时,溶液中溶质的成分为___;
(2)碳酸钠的质量m=___;
(3)盐酸的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是_____,⑧的元素符号是_____。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____;名称是________; 碱性最强的化合物的电子式是:_________; 属_____化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____, ⑦的最简单氢化物的电子式为_____,结构式为_____。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其核电荷数,请你根据下面的提示做出自己的判断。
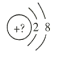
(1)若该微粒是电中性微粒,这种微粒的元素符号是___。
(2)若该微粒的还原性很弱,失去1个电子后变为原子,该原子的单质氧化性很强,该单质与水反应的化学方程式为___。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,该原子的单质还原性很强,该单质在氧气中燃烧所得产物的化学式为___。
(4)若该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:![]() ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向 20 mL 0.1 mol/L NaOH 溶液中逐滴加入 0.1 mol/L 醋酸溶液,滴定曲线如图所示。下列说法正确的是
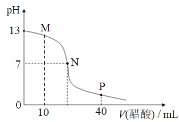
A.该NaOH 溶液中水电离出的 c(OH-)=1×10-12 mol/L
B.M 点时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.P 点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.N 点对应的横坐标是 20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com