
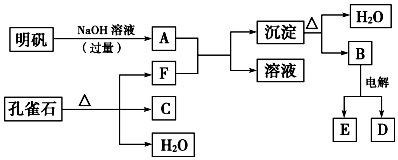
分析 孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物B为氧化铝,电解熔融氧化铝生成铝和氧气,据此解答.
解答 解:孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物B为氧化铝,电解熔融氧化铝生成铝和氧气,
(1)由上述分析可知F为CO2,故答案为:CO2;
(2)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(3)G为氧化铜,若D为固体,则D为Al,铝和氧化铜高温下的发生铝热反应,该反应化学方程式为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3,
故答案为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
点评 本题为框图式物质推断题,难度不大,根据碱式碳酸铜分解反应与明矾与是氢氧化钠反应反应产物进行推断,掌握物质的性质是关键.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与稀硝酸的反应:Cu+4H++2NO3-→Cu2++2NO2↑+2H2O | |
| B. | 稀NaOH溶液中滴加少量NH4Cl溶液:OH-+NH4+→NH3?H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液反应:OH-+NH4++SO42-+Ba2+→NH3↑+H2O+BaSO4↓ | |
| D. | FeS溶于稀HNO3:FeS+H+→Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 己知H2O2的分子空间结构如图,两个平面的夹角为93°,两个O-H键与O-O键之间的夹角均为96°.有关H2O2结构的说法中不正确的是( )
己知H2O2的分子空间结构如图,两个平面的夹角为93°,两个O-H键与O-O键之间的夹角均为96°.有关H2O2结构的说法中不正确的是( )| A. | 过氧化氢分子中氧原子sp3杂化 | B. | 易溶于有机溶剂 | ||
| C. | 过氧化氢分子间存在氢键 | D. | H2O2是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa 下,n(NH3)和 n(H2)随时间 t 变 化的关系示意图如图所示.下列叙述中正确的是( )
合成氨工业对国民经济和社会发展具有重的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa 下,n(NH3)和 n(H2)随时间 t 变 化的关系示意图如图所示.下列叙述中正确的是( )| A. | c 点处正反应速率和逆反应速率相等 | |
| B. | a 点处正反应速率比 b 点处的大 | |
| C. | d 点(t1 时刻)和 e 点(t2 时刻)处 n(N2)不同 | |
| D. | t2 时刻,正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大于后者 | B. | 前者小于后者 | ||
| C. | 两者相等 | D. | 没有相关燃烧热数据,无法对比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究固体物质的表面积对反应速率的影响 |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com