
科目:高中化学 来源:不详 题型:单选题
| A.有些物质是由原子直接构成,如金刚石、水晶等;有些物质是由分子直接构成,如干冰、氯化铵等;有些物质是由离子直接构成的,如食盐、烧碱等 |
| B.BF3、H2O、SiCl4、PCl5四种分子中所有原子都满足最外层为8电子结构 |
| C.非金属氧化物不都是酸性氧化物;碱性氧化物都是金属氧化物 |
| D.硫单质的熔点比钠单质的熔点高,这是由于前者比后者有更大的范德华力所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.baedc | B.edabc |
| C.abdce | D.cdeab |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子还原性Y2->Z- | B.质子数c>b |
| C.氢化物稳定性H2Y>HZ | D.原子半径X<W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
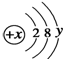 ,试回答:
,试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com