
分析 达到平衡时,测得c(H2)=0.08mol/L,则 2HI(g)?H2(g)+I2(g)
起始时各物质的浓度(mol•L-1) 0.2 0 0
各物质的浓度变化量(mol•L-1) 0.16 0.08 0.08
平衡时各物质的浓度(mol•L-1) 0.04 0.08 0.08
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的碘化氢为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
解答 解:达到平衡时,测得c(H2)=0.08mol/L,则 2HI(g)?H2(g)+I2(g)
起始时各物质的浓度(mol•L-1) 0.2 0 0
各物质的浓度变化量(mol•L-1) 0.16 0.08 0.08
平衡时各物质的浓度(mol•L-1) 0.04 0.08 0.08
(1)平衡时c(H2)=c(I2)=0.08mol/L,c(HI)=0.04mol/L,
则K=$\frac{0.08×0.08}{0.04{\;}^{2}}$=4,
答:该反应的平衡常数为4;
(2)在上述温度下,该容器中若充入碘化氢0.4mol,设HI转化了x
则 2HI(g)?H2(g)+I2(g)
起始时各物质的浓度(mol•L-1) 0.4 0 0
各物质的浓度变化量(mol•L-1) x 0.5x 0.5x
平衡时各物质的浓度(mol•L-1) 0.4-x 0.5x 0.5x
K=$\frac{0.5x×0.5x}{(0.4-x){\;}^{2}}$=4,
解得:x=0.32 mol;
碘化氢转化率=$\frac{0.32mol}{0.4mol}$×100%=80%
所以平衡时c(H2)=$\frac{0.5×0.32mol}{1L}$=0.16mol/L;
答:平衡时碘化氢的转化率为80%,氢气的物质的量浓度为0.16mol/L.
点评 本题考查化学平衡的计算,明确化学平衡的三段法计算格式及平衡常数的计算方法是解答本题的关键,注意利用平衡浓度计算平衡常数,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
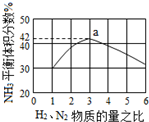 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
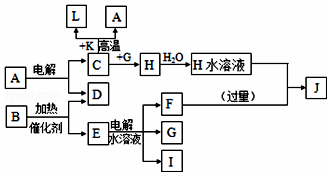 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: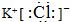
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com