
【题目】将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是( )
A.硫酸锌
B.氯水
C.氯化铜
D.硝酸钠
科目:高中化学 来源: 题型:
【题目】某铅氧化物(PbxOy),其中Pb有+2、+4两种化合物。研究小组测定其化学组成,实验流程如下:
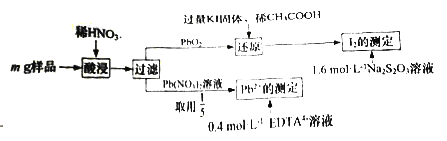
测定过程涉及如下反应:I2+2Na2S2O3=2NaI+Na2S4O6
Pb2++EDTA4-=PbEDTA2-
⑴配制250mL1.6 molL-1的Na2S2O3溶液,需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管和_________________。
⑵过滤后,洗涤PbO2固体的操作为______________。
⑶“还原”过程中生成I2、CH3COOK、(CH3COO)2Pb,写出该反应的化学方程式______________;“I2的测定”中,应在滴入Na2S2O3溶液前,预先加入________________,以判断反应是否完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A. 该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B. 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A—)>c(HA)>c(Na+)>c(H+)>c(OH—)
C. 0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中2c(H+)+ c(HA) = c(A—) + 2c(OH—)
D. 0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中c(A—) + c(HA) = c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.黄绿色的氯水光照后颜色变浅
C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深
D.工业合成氨反应中加压有利于提高氨气的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】( 15 分)
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
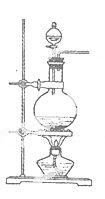
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3) = 2.8×10-9、Ksp(MnCO3) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。
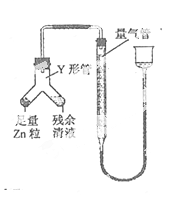
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气、可燃冰、页岩气、沼气的主要成分都是甲烷,甲烷既是一种清洁能源,也是一种重要的化工原料。
(1)以甲烷为主要原料可生产合成气(CO和H2)。
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.0 kJ·mol-1
③2CO(g)+O2(g)===2CO2(g)
ΔH=-566.0 kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=__________________。
2CO(g)+2H2(g)的ΔH=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CO2(g)+CH4(g) ![]() CH3COOH(g)。
CH3COOH(g)。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是_________________________。
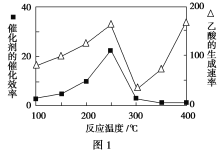
②为了提高该反应中CH4的转化率,可以采取的措施是______________________(写出一条即可)。
(3)甲烷燃料电池是一种新型电池。如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ可实现铁棒上镀铜。
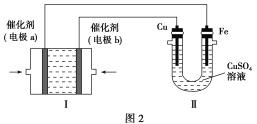
①电极b上的电极反应式是______________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗的氧气在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com