
【题目】A同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
[提出问题]为什么会生成淡黄色固体?
[查阅资料]该同学查阅资料,记录了右
表中几种物质的颜色:
(1)其他同学认为不必查阅氯化镁的颜色,理由是 ;
(2)[提出猜想]分析资料,A同学认为淡黄色固体可能是由镁与空气中的 反应生成的;
(3)[实验探究]该同学设计实验证实了自己的猜想,他的方案可能是 将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体 ;
(4)[实验结论]根据该同学的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程式: 、 ;
(5)[反思与评价]通过上述实验,你对燃烧有什么新的认识? .
【答案】空气的成分中不含氯元素;氮气(或N2);2Mg+O2![]() 2MgO;3Mg+N2
2MgO;3Mg+N2![]() Mg3N2;燃烧不一定要有氧气
Mg3N2;燃烧不一定要有氧气
【解析】(1)因空气的成分中不含氯元素,不能生成氯化镁,则不必查阅氯化镁的颜色,所以答案是:空气的成分中不含氯元素;
(2)[提出猜想]空气中含氧气、单质,氧气与Mg反应生成白色的MgO,则淡黄色固体可能是由镁与空气中的氮气(或N2)反应生成,所以答案是:氮气(或N2);
(3)[实验探究]将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体,可验证猜想,所以答案是:将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体;
(4)[实验结论]镁条在空气中燃烧时两个反应的化学方程式分别为2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2 , 所以答案是:2Mg+O2
Mg3N2 , 所以答案是:2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2;
Mg3N2;
(5)[反思与评价]由Mg在空气中发生的两个反应可知,燃烧不一定要有氧气参加,所以答案是:燃烧不一定要有氧气.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,使海水分解得到氢气的新技术:
2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,实现了从________能转变为________能。生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于_______反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是________,发生的电极反应为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: 
(1)实验中观察到的现象是 .
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐.我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进.氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行.
A.①②
B.①③
C.③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 第IA族又叫碱金属元素,第VIIA族元素又叫卤族元素,0族元素又叫稀有气体元素
B. Ba(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共18纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置中,A、F分别为NH3和Cl2的发生装置. 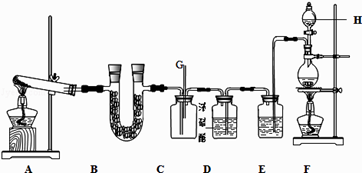
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)甲、乙两同学分别采用下列两种方案制取C12:甲:用含HCl 146g的浓盐酸与足量的MnO2反应.乙:用87g MnO2与足量浓盐酸反应.则所得氯气(填字母). a.甲比乙多b.乙比甲多c.一样多
(3)仪器H的名称是(填名称),装置E的作用是 .
(4)装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用进行尾气处理(填选用试剂的名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
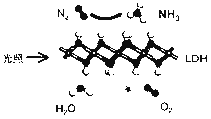
A. 该过程将太阳能转化成为化学能 B. 该过程中,涉及极性键与非极性键的断裂与生成
C. 氧化产物与还原产物的物质的量之比为3∶4 D. 该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的同位素![]() X,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素中有20个中子,求:
X,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素中有20个中子,求:
(1)Z和A的值:Z:________、A:________。
(2)X元素在周期表中的位置:________。
(3)写出XCl2与AgNO3反应的化学方程式 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com