
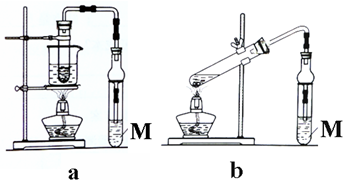
分析 (1)乙醇与乙酸发生酯化反应生成乙酸乙酯,M中饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,利于分层;
(2)乙酸乙酯与饱和碳酸钠溶液分层,应充分振荡后静置分层;
(3)图b直接加热时乙醇、乙酸易挥发,且乙醇可发生分子间脱水反应,而图a中水浴加热可控制温度,以此来解答.
解答 解:(1)溶液M的名称为饱和碳酸钠,故答案为:饱和碳酸钠;
(2)反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液,故答案为:振荡;静置;
(3)若用b装置制备乙酸乙酯,其缺点有原料损失较大、易发生副反应,故答案为:原料损失较大、易发生副反应.
点评 本题考查混合物分离提纯,为高频考点,把握乙酸乙酯的制备原理、混合物分离提纯实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入氯化钡溶液有白色沉淀生成,且沉淀不溶于稀盐酸,则原溶液一定含有SO42- | |
| B. | 某溶液中加入盐酸放出能使澄清的石灰水变浑浊的无色无味的气体,则原溶液一定含有CO32- | |
| C. | 检验某溶液中是否含有Fe3+时,可滴加硫氰化钾溶液,若溶液由无色变为血红色,则说明溶液中一定含有Fe3+ | |
| D. | 某溶液进行焰色反应,火焰颜色呈黄色,说明原溶液中一定不存在钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ③②④① | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强p p甲=p丙>2p乙 | |
| B. | SO3的质量m m甲=m丙<2m乙 | |
| C. | c(SO2)与c(O2)之比k k甲=k丙>2k乙 | |
| D. | 反应放出或吸收热量的数值Q Q甲=197-Q丙>2Q乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用NaOH溶液除去铝表面的氧化膜时产生气泡:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ | |
| C. | 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将铁粉加入稀硫酸和硝酸钾混合溶液中,铁粉溶解:Fe+2H+=Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

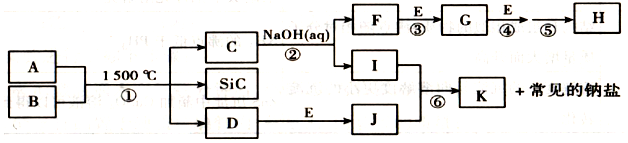
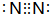 ,G的化学式:NO;
,G的化学式:NO;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com