
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 甲烷与乙烯的混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去甲烷中的乙烯 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
甲烷可用氧化铁作催化剂实现选择性地催化脱硝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
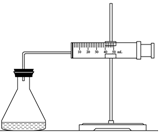 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
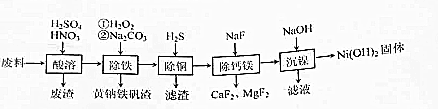
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子的电子式是: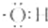 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
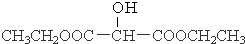 .
.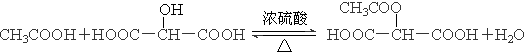 .
.
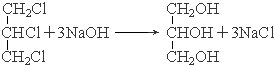 .
.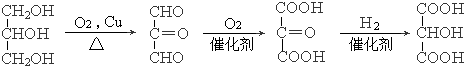 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com