
| A. | v (NH3)=0.2 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=0.9 mol/(L•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位要一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快.
A.v (NH3)=0.2 mol/(L•s)=12mol/(L•min),$\frac{v(N{H}_{3})}{4}$=3 mol/(L•min);
B.$\frac{v({O}_{2})}{5}$=0.28mol/(L•min);
C.v (H2O)=0.25 mol/(L•s)=15mol/(L•min),$\frac{v({H}_{2}O)}{6}$=2.5mol/(L•min),
D.$\frac{v(NO)}{4}$=0.225mol/(L•min),
故用氨气表示的反应速率最快,
故选A.
点评 本题考查化学反应速率快慢的比较,可以转化为同一物质表示的速率进行比较,注意单位保持一致,难度不大.


科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
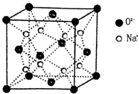 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
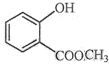 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.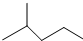 表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3.
表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C-O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ |
| 0.1mol•L-1CH3COOH溶液 | 0.01mol•L-1CH3COOH溶液 | pH=3的CH3COOH溶液 | 0.1mol•L-1NaOH溶液 | 0.1mol•L-1氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 具有足够能量的分子相互碰撞不一定能发生化学反应 | |
| B. | 强酸溶液的导电能力不一定比弱酸溶液大 | |
| C. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 溶度积大的化合物溶解度一定大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com