
工业上采用接触法生产硫酸时,使用的三种主要设备是________.
(1)某厂采用该方法生产硫酸,取1.00g黄铁矿样品(所含杂质不挥发且不与氧气反应),在氧气中充分灼烧,完全反应后,冷却称量固体残留物,质量为0.75g.则矿石样品中FeS2的质量分数为________.
(2)若生产过程中,FeS2燃烧时损失2%;由SO2氧化成SO3时,SO2转化率为80%.则用10.0t这种黄铁矿可生产98%的硫酸________t.
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
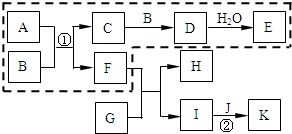 硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.
硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com