
【题目】20℃,反应N2O4![]() 2NO2 △H>0在密闭容器中达平衡,下列说法不正确的
2NO2 △H>0在密闭容器中达平衡,下列说法不正确的
A. 体积不变时加入少许NO2,再度平衡时颜色变深
B. 体积不变时加入少许N2O4,平衡正向移动,N2O4转化率减小
C. 容器体积减小时,平衡逆向移动,正反应速率减小,逆反应速率增大
D. 体积不变时升高温度,再度平衡时颜色变深
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
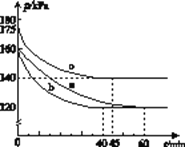
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b__________________,c_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法可行的是( )
A. 除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸
B. 除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤
C. 除去NH4Cl固体中少量I2:加热,I2升华除去
D. 除去乙烯中的少量SO2:通过酸性KMnO4溶液,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物的顺序排列的是( )
A. 液态氧、烧碱、碘酒 B. 白磷、生石灰、熟石灰
C. 铁、干冰、氯化氢 D. 氮气、空气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:

已知:
i.酸洗钢制构件后得到废酸的主要成分如下表所示。

ii.pH <4时,Fe2+不易被氧气氧化。
(1)用离子方程式解释废酸中不含Fe3+的原因______________________________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq) ![]() FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是__________________________________(写出一点即可)。
②用化学平衡原理解释鼓入空气的目的:_________________________________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________________________________。
(4)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X-![]() RX +OH-(X-表示FeCl4-)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-(X-表示FeCl4-)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-![]() Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液的pH将会_______________。(填“升高”、“降低”或“不变”)
②洗脱液经处理后有许多用途,下列用途合理的是_________________。
A、刻蚀印刷铜线路板 B、净化污水 C、自来水消毒 D、浸泡生物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
①合成甲醇的反应为______(填“放热”或“吸热”)反应。
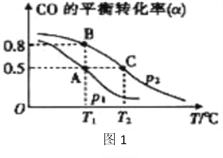
②A、B、C三点的平衡常数KA、KB、KC的大小关系为__________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_______________L。
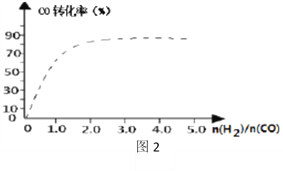
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com