
分析 A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大,A的基态原子有3个不同的能级,各能级中电子数相等,核外电子排布为1s22s22p2,则A为C元素;C的基态原子2p能级上的未成对电子数与A原子相同,核外电子排布为1s22s22p4,则C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D的基态原子的M电子层上有4个未成对电子,核外电子排布为1s22s22p63s23p63d64s2,则D为Fe,据此解答.
解答 解:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等,核外电子排布为1s22s22p2,则A为碳元素;C的基态原子2p能级上的未成对电子数与A原子相同,核外电子排布为1s22s22p4,则C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D的基态原子的M电子层上有4个未成对电子,核外电子排布为1s22s22p63s23p63d64s2,则D为Fe.
(1)D为Fe元素,处于第四周期第ⅤⅢ族,属于d区元素,原子核外有26个电子,基态原子的外围电子排布式为3d64s2,其正二价离子的外围电子排布式为3d6,
故答案为:d;3d6;
(2)同周期随原子序数增大,元素第一电离能层增大趋势,但是由于N元素得的2p轨道处于半充满状态,故第一电离能氮大于氧,故第一电离能N>O>C,
故答案为:N>O>C;
(3)离子OCN-与分子CO2互为等电子体,则OCN-中C原子与氧原子、N原子之间分别形成2对共用电子对,C原子的杂化方式为sp;
NH3分子间存在氢键,而CH4分子间只存在范德华力,氢键作用力远大于范德华力,所以NH3的沸点更高,
故答案为:sp;NH3分子间存在氢键,而CH4分子间只存在范德华力,氢键作用力远大于范德华力,所以NH3的沸点更高;
(4)Fe(CO)5中Fe元素化合价为0价,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体,
故答案为:0;分子晶体;
(5)NaCl晶胞如图: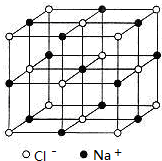 ,则黑球可以看成是C原子,“小立方体”中可放置四个C原子,故CO2晶胞中有4+1+12×$\frac{1}{4}$=8个C原子,故含有O原子数目为8×2=16;
,则黑球可以看成是C原子,“小立方体”中可放置四个C原子,故CO2晶胞中有4+1+12×$\frac{1}{4}$=8个C原子,故含有O原子数目为8×2=16;
设“小立方体”的边长为a,中心C原子与小立方体中心C原子的距离为$\frac{\sqrt{3}}{2}$a<$\sqrt{2}$a,故最近的两个C原子的距离是$\frac{\sqrt{3}}{2}$a,晶胞质量为8×$\frac{44}{{N}_{A}}$g,若CO2的晶体的密度为d g.cm-3,则晶胞体积为8×$\frac{44}{{N}_{A}}$g÷d g.cm-3=$\frac{352}{{N}_{A}}$cm3,则AC原子间的最短距离为$\root{3}{\frac{352}{{N}_{A}}}$cm×$\frac{1}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{2}$=$\frac{\sqrt{3}}{8}×\root{3}{\frac{352}{{N}_{A}}}$cm,
故答案为:8;16;$\frac{\sqrt{3}}{8}×\root{3}{\frac{352}{{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化方式、氢键、晶体类型的判断、晶胞计算等,(5)为易错点、难点,需要学生具备一定的空间想象与数学计算能力,熟练识记中学常见晶胞结构.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 硝酸溶液和烧碱溶液反应 | ||
| C. | 醋酸和KOH溶液反应 | D. | 盐酸和氢氧化铁反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A. | c(HC03-)>c(C10- )>c(OH-) | |
| B. | c(Na+)=c(C1O-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3 -)+c(H2CO3)+c(CO32-) | |
| D. | (Na+)+c(H+)=c(HCO3-)+c(ClO- )+c(OH-)+2 c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--二氧化碳 | B. | 酸雨--二氧化碳 | ||
| C. | 白色污染--废塑料制品 | D. | 臭氧层破坏--氟氯代烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与溴化氢混合 | B. | 将乙烯通入溴的四氯化碳溶液中 | ||
| C. | 乙烷与溴蒸气混合 | D. | 将乙炔通入溴的四氯化碳溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com