
已知KNO3晶体溶解于水时要吸收热量,从溶液中析出KNO3晶体时会放出热量.若有室温下KNO3饱和溶液20mL,向其中加入1g KNO3晶体,充分搅拌后,下列判断正确的是( )
A. 溶液质量增加 B. 溶液的温度降低
C. 晶体不再溶解 D. 溶液的温度和质量都不变
考点: 溶解度、饱和溶液的概念.
分析: 该溶液为KNO3饱和溶液,所以加入新的KNO3晶体,对饱和溶液体系并没有影响,所以溶液的温度和质量都不会有变化.
解答: 解:A.室温下KNO3饱和溶液20ml,向其中加入1gKNO3晶体,加入前溶液已经饱和,故1gKNO3晶体不会溶解,溶液的质量不变,故A错误;
B.KNO3晶体不断的溶解,不断地析出,溶解等于析出的质量,不放出或吸收热量,温度不变,故B错误;
C.KNO3晶体不断的溶解,不断地析出,是一个动态平衡,故C错误;
D.室温下KNO3饱和溶液20ml,向其中加入1gKNO3晶体,加入前溶液已经饱和故1gKNO3晶体不会溶解,溶液的质量不变,故D正确.
故选D.
点评: 本题考查溶解度、饱和溶液的概念,判断溶液是否饱和不能让题意中的文字叙述迷惑你,一定要根据饱和溶液与不饱和溶液的概念分析作答.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为()
A. 纯盐酸、空气、硫酸、干冰
B. 蒸馏水、氨水、碳酸氢钠、二氧化硫
C. 胆矾、盐酸、铁、碳酸钙
D. 生石灰、漂白粉、氯化铜、碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能有下列阴离子中的一种或几种:SO42﹣、CO32﹣、Cl﹣、OH﹣.
(1)当溶液中有大量H+存在时,则不可能有 存在,发生反应的离子方程式 ;
(2)当溶液中有大量Ba2+存在时,则不可能有 ﹣ 存在,发生反应的离子方程式 ;
(3)检验某溶液中是否存在SO42﹣的试剂为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D. 电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na和Na+性质的叙述正确的是( )
A. 它们都显碱性
B. 它们都有强还原性
C. 它们都能跟H2O、O2反应
D. Na只有还原性,Na+只有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立于水中,各试管中水面上升高度应为( )
A. ①>②>③>④ B. ②>③>④>① C. ①=②=③=④ D. ③>②>①>④
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为( )
A. 3:1 B. 3:2 C. 1:2 D. 6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的五中元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是()
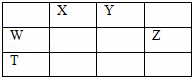
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2,W3X4,WZ4均有熔点高,硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com