
【题目】已知酸式盐NaHB在水溶液中存在下列变化:①NaHB===Na++HB-,②HB-![]() H++B2-,③HB-+H2O
H++B2-,③HB-+H2O![]() H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
A. 0.01 mol·L-1的NaHB溶液,其pH可能为2
B. NaHB及H2B均为强电解质
C. 该酸式盐溶液中水电离出的氢离子浓度小于纯水中水电离出的氢离子浓度。
D. HB-的电离程度小于HB-的水解程度
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知 Cu2S+2Cu2O ![]() 6Cu+SO2↑,下列说法正确的是
6Cu+SO2↑,下列说法正确的是
A. 该反应中的氧化剂只有Cu2O
B. Cu2O在反应中既是氧化剂又是还原剂
C. Cu既是氧化产物又是还原产物
D. 氧化产物与还原产物的物质的量之比为1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
A. Na2O2中阴、阳离子的个数比为1∶1
B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D. Na2O2漂白后的有色物质受热后能恢复原色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质)与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅)
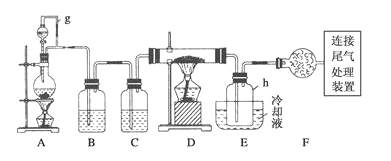
相关信息如下:a.四氧化硅遇水极易反应生成硅酸和氯化氢;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出用碳在高温下还原二氧化硅制得粗硅的化学方程式_________________________。
(2)写出装置A中发生反应的离子方程式__________________________________。
(3)装置A中g管的作用是_________________;装置C中的试剂是____________;
(4)装置E中h瓶收集到的粗产物可通过多次蒸馏得到高纯度四氯化硅,蒸馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(5)写出尾气处理装置中发生反应的离子方程式___________________________。
(6)本题实验装置中有一明显的不足之处,请简述你的改进方案及理由: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是

A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KC1O3和草酸(H2C2O4)在60℃时反应制得。某学生用下图所示的装置模拟工业制取及收集C1O2,其中A为C1O2的发生装置,B为C1O2的凝集装置,C为尾气吸收装置。
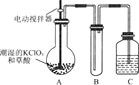
请回答下列问题:
(1)A中反应产物有K2CO3、C1O2和CO2等,请写出该反应的化学方程式:________________________。
A部分还应添加温水浴控制温度在60 °C,B部分还应补充什么装置:_________________。
(2)该装置按(1)补充完整后,装置A、B、C中还有一处设计明显不合理的是_____(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为____________。若实验时需要450 mL 4 mol L-1的NaOH溶液,则在精确配制时,需要称取NaOH的质量是____g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
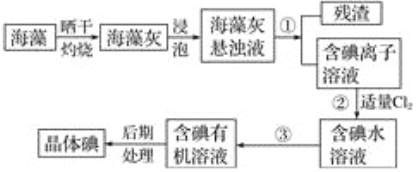
(1)实验室焙烧海带,需要下列仪器中的________(填字母)。
a.试管 b.烧杯c.坩埚 d.泥三角e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③________。
(3)提取碘的过程中,可选择的有机试剂是________(填字母)。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有________、________。
(5)小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_________________________________________。
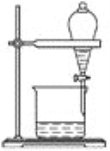
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
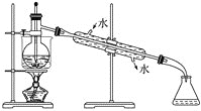
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是________________________________________________,最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。
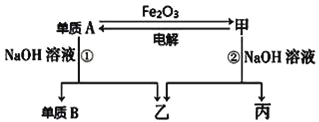
根据图示转化关系回答:
(1)写出反应①的离子方程式:_________________。
(2)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl b.KClO 3 c.MnO2 d.Mg
(3)利用该反应的原理,工业上可用于___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com