
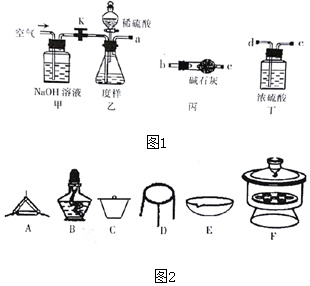
分析 (1)4MgCO3•Mg(OH)2•5H2O与稀硫酸反应生成硫酸镁、水和二氧化碳;
(2)取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度,打开K利用装置甲是通入空气,通过氢氧化钠溶液吸收二氧化碳防止干扰二氧化碳测定,干净装置内空气,关闭K,通过装置乙分液漏斗滴入稀硫酸发生反应生成二氧化碳、水和硫酸镁,通过装置丁吸收气体中的水蒸气,通过装置丙吸收生成的二氧化碳测定质量,为避免空气中二氧化碳、水蒸气进入干燥管,可以再连接干燥管;
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是把装置内空气赶净;
(4)煅烧固体选择坩埚内加热灼烧,需要三脚架、泥三角、酒精灯、玻璃棒等,干燥应在干燥器中进行,据此分析判断
(5)判断样品完全分解的方法是重复操作②,测得剩余固体质量为m1g到恒重,或两次称量误差不超过0.1g;
(6)发生MgCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$MgSiO3+CO2↑,对测定二氧化碳的质量无影响;
解答 解:(1)乙中发生反应是碱式碳酸铜和稀硫酸发生复分解反应生成硫酸镁、水和二氧化碳,反应的化学方程式为:4MgCO3•Mg(OH)2•5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑,
故答案为:4MgCO3•Mg(OH)2•5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑;
(2)取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度,打开K利用装置甲是通入空气,通过氢氧化钠溶液吸收二氧化碳防止干扰二氧化碳测定,干净装置内空气,关闭K,通过装置乙分液漏斗滴入稀硫酸发生反应生成二氧化碳、水和硫酸镁,通过装置丁吸收气体中的水蒸气,通过装置丙吸收生成的二氧化碳测定质量,为避免空气中二氧化碳、水蒸气进入干燥管,可以再连接干燥管,仪器接口的连接顺序为a→d→e→b→c→b→c,丁的作用是除去二氧化碳气体中的水蒸气,
故答案为:d→e→b→c→b→c;除去二氧化碳气体中的水蒸气;
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是:打开止水夹K从甲中通入空气,把生成的二氧化碳气体全部赶入干燥管吸收,
故答案为:打开止水夹K从甲中通入空气,把生成的二氧化碳气体全部赶入干燥管吸收;
(4)取碱式碳酸镁样品mg;②将样品充分高温燃烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量),煅烧固体选择坩埚内加热灼烧,需要三脚架、泥三角、酒精灯、玻璃棒等,干燥应在干燥器中进行,所以不需要的是蒸发皿,
故答案为:E;
(5)判断样品完全分解的方法是样品连续两次高温煅烧,冷却称量质量相差0.1g以内,
故答案为:样品连续两次高温煅烧,冷却称量质量相差0.1g以内;
(6)发生MgCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$MgSiO3+CO2↑,该反应的发生不影响生成CO2和水蒸气的量,这位同学的观点是错误的,
故答案为:错误;该反应的发生不影响生成CO2和水蒸气的量.
点评 本题考查了物质组成、物质含量的测定方法、实验基本操作、装置作用和连接顺序,主要是不同的测定方法需要仪器的选择和理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 燃着的酒精灯打翻失火,立即用水浇灭 | |
| B. | 若不慎将浓碱液沾在皮肤上,立即用大量水冲洗,再涂上适量的稀硼酸溶液 | |
| C. | 用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 | |
| D. | 配制稀硫酸时,可先在量筒中加入一定量的水,再在搅拌下缓慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g CuO和Cu2S的混合物中,所含铜原子数为NA | |
| B. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为4NA | |
| C. | 常温下,2L 0.1 mol•L-1FeCl3 溶液与 1L 0.2 mol•L-1FeCl3 溶液所含 Fe3+数目不同 | |
| D. | 100g质量分数为46%的乙醇溶液中含有NA个-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
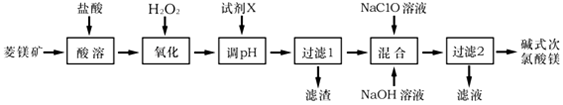
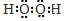 ,它的作用是将Fe2+氧化为Fe3+.
,它的作用是将Fe2+氧化为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 保证食品安全、保持营养均衡、合理用药是保障人体健康的基础.
保证食品安全、保持营养均衡、合理用药是保障人体健康的基础.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com