
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
分析 A、可燃冰燃烧后生成二氧化碳和水;
B、由非金属元素形成的化合物绝大多数为共价化合物;
C、可燃冰存在于低温高压环境下;
D、天然气降温加压后仍然为甲烷.
解答 解:A、可燃冰燃烧后生成二氧化碳和水,对环境无污染,故为清洁能源,故A正确;
B、由非金属元素形成的化合物绝大多数为共价化合物,而CH4•nH2O全部由非金属元素构成,故为共价化合物,故B错误;
C、可燃冰存在于低温高压环境下,在常温常压下不能稳定存在,故C错误;
D、天然气的主要成分是甲烷,故天然气降温加压后仍然为甲烷,不会是甲烷的水合物,故D错误.
故选A.
点评 本题对化学非常规物质进行了考查,做此类题目时,要注意结合所给的新信息,运用已有知识进行分析判断.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
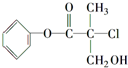 某有机物A是农药生产中的一种中间体,其结构简式如图所示.
某有机物A是农药生产中的一种中间体,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
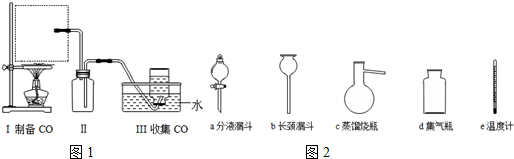
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
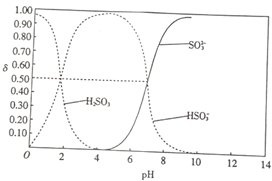 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有18个族 | |
| C. | ⅠA族的元素不全都是金属元素 | |
| D. | 短周期指的是一、二、三、四周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置图 |  |  | 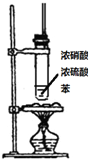 | 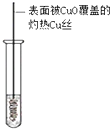 |
| 实验目的 | 分离乙酸乙酯、碳酸钠和水的混合物 | AgNO3验证苯与液溴发生取代反应 | 制备硝基苯 | 验证乙醇的还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com