
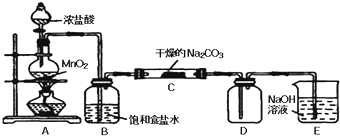
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。
已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中固体含有NaHCO3 ,且含氯的盐只有一种。现对C的成分进行猜想和探究。

(1)提出合理猜想:若已知C中有0.1molCl2恰好和10.6克Na2CO3固体完全反应。则C中有Cl2参与反应的化学方程式可能 。
(2)①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计合理方案对C固体中的未知成分进行探究。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、Ba(OH)2溶液、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 |
|
|
步骤2: |
|
|
步骤3: |
|
|
|
|
Ⅱ探究铁矿石中铁的含量将2. 25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250 mL,利用反应 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 对铁矿石中铁元素的含量进行测定。
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150 mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是 。
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00 mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56) 。
③在本实验的滴定过程中,下列操作会使测定结果偏小的是 (填写序号)。
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
Ⅰ(1)2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O (2分)
(2)假设一:NaCl (1分)
假设二:NaCl、 Na2CO3 (1分)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 |
|
|
步骤2:向A试管中滴加足量BaCl2溶液(1分) |
若无明显现象,则C固体中不含Na2CO3(1分)若溶液变浑浊,则C固体中含Na2CO3(1分) |
|
步骤3:向B试管中滴加足量稀硝酸,再加适量 AgNO3溶液(1分) |
若无明显现象,则C固体中不含NaCl(1分)若溶液变浑浊,则C固体中含NaCl(1分) |
Ⅱ①100mL容量瓶(2分) ②56%(2分) ③c(2分)
【解析】
试题分析:解:(1)C中有0.1mol Cl2参加反应。装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,若假设一成立,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价:可推知C中反应生成的含氯氧化物为Cl2O;反应的化学方程式为:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O。
(2)在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物)。C中含氯元素的盐只有一种,且含有NaHCO3。
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3。
步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒,步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
假设一:存在NaHCO3和NaCl;
假设二:存在NaHCO3和NaCl、Na2CO3;
|
实验步骤 |
预期现象和结论 |
|
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
无明显现象 |
|
步骤2:向A试管中滴加BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
|
步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl |
Ⅱ①配制溶液的玻璃仪器除了烧杯、玻璃棒、胶头滴管以外,还需要容量瓶,因为题中需要配制的是100ml的标准液,所以应该选用100ml的容量瓶。
②铁矿石中的铁元素全部转化为了二价铁,并且由K2Cr2O7溶液滴定,所以由方程式可计算:
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 : 1
n(Fe2+) = 6 n(Cr2O72-) =6×0.0150 mol/L×25.00 mL ×10-3=2.25×10-3mol
又每次滴定只取25ml,所以n(Fe2+)总=2.25×10-2mol,所以w(Fe)=[n(Fe)×M/m总] ×100%=2.25×10-2mol×56g/mol÷2.23g×100%=56%,所以铁矿石中铁元素的百分含量是56%。
③a未用标准K2Cr2O7溶液润洗滴定管,会导致残留滴定管的水稀释标准液,这样导致标准液浓度减小,消耗体积增大,所以根据n=c×V可知若V偏大,则计算中n偏大,导致测定结果偏大;
b锥形瓶中是盛装待测液的,只要取得待测无误,锥形瓶中加水稀释不影响实验结果;
c若滴定时抖动过于剧烈,锥形瓶外溅有液体,则待测液损失,需要的标准液减少,则使得滴定结果偏小,故选c。
考点:本题考查的是实验探究和氧化还原滴定。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤l:取c中的少量固体样品于试管中,滴加足量蒸馏 水至同体溶解,然后将所得溶液分别置于a、b试管中. |
无明显现象 无明显现象 |
| 步骤2: 向A试管中滴加适量BaCl2溶液 向A试管中滴加适量BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | 无明显现象 无明显现象 |
| 步骤2: 向A试管中滴加BaCl2溶液 向A试管中滴加BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中. | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a. a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
b. 若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中. | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置 | 若溶液变浑浊,证明固体中含碳酸钠. |
| 步骤3: |
|
| 步骤4: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com