
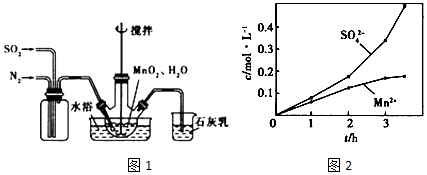
分析 (1)①MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,据此书写反应方程式;石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水;
②为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
③考虑氮气的化学性质稳定,空气中氧气的活泼性等因素的影响;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,故反应的离子方程式为:MnO2+H2SO3=MnSO4+H2O;石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应为SO2+Ca(OH)2=CaSO3+H2O;
故答案为:MnSO4+H2O;SO2+Ca(OH)2=CaSO3+H2O;
②为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
故答案为:控制适当的温度、缓慢通入混合气体;
③氮气的化学性质稳定,空气中氧气性质活泼,在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大;
故答案为:Mn2+催化氧气与亚硫酸反应生成硫酸;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,所以实验步骤为:①边搅拌边加入 Na2CO3,并控制溶液pH<7.7;②过滤,用少量水洗涤2~3次;③检验SO42-是否被洗涤干净:取最后一次洗涤液于试管中,滴加BaCl2溶液,再滴加稀盐酸,若无沉淀生成,则洗涤干净;④用少量乙醇洗涤;⑤低于100℃干燥;
故答案为:①碳酸钠;<;
②过滤,用少量水洗涤2-3次;
③检验SO42-是否被洗涤干净;
④用少量的乙醇洗涤.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3和 NaOH | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和 H2SO4 | D. | Na2CO3和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 与稀盐酸反应的剧烈程度Na2CO3>NaHCO3 | |
| D. | 等质量的固体与足量盐酸反应放出CO2的质量Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| B. | PM2.5是指大气中直径接近2.5×l0-6m的颗粒物,分散在空气中形成胶体 | |
| C. | 石英用于生产光导纤维和计算机芯片 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时HI的分解率20% | B. | 反应起始时固体NH4I是5 mol | ||
| C. | 平衡时,c (NH3)=4.5mol/L | D. | 平衡时HI的分解率10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
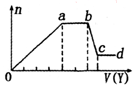 某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+ | |
| B. | 若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是浓硫氰化钾溶液,红色都会加深 | |
| C. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,滴定前仰视读数,滴定后俯视读数会导致待测碱液浓度结果偏高 | |
| D. | 实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com