
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式_________________。
(2)298 K时,在2L恒容密闭容器中发生反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图1。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图1。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
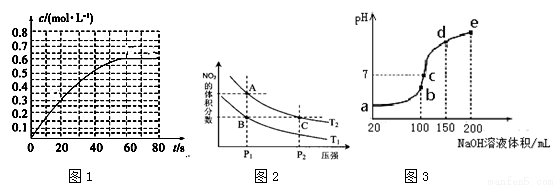
①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示。
下列说法正确的是( )
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图3所示。试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届山东省高三5月高考拉练一模理综化学试卷(解析版) 题型:选择题
常温下向1L 0.1mol·L-1NH4C1溶液中,不断加入NaOH固体后,NH4+与NH3·H2O浓度的变化趋势如右图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是
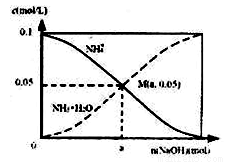
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随着NaOH的加入,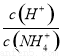 不断减小
不断减小
D.当n(NaOH)=0.1mol时, c(OH-)>c(Cl-)>c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:选择题
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH===CHR2,被氧化为 被氧化为
被氧化为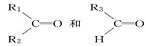 ,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有
,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有
A.2种 B.3种
C.4种 D.6种
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三高考前模拟理综化学试卷(解析版) 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
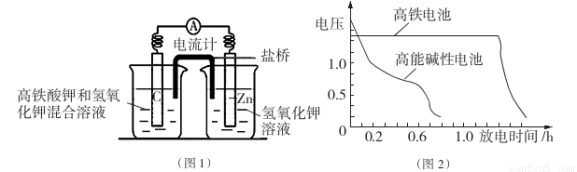
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作10 min ,理论消耗Zn g(已知F=96500 C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有 。
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
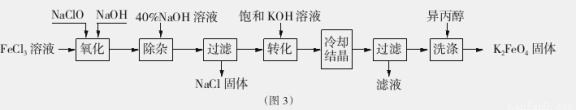
(4)完成“氧化”过程中反应的化学方程式:
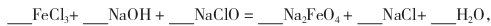
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×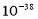 ,此温度下若在实验室中配制5mol/L
,此温度下若在实验室中配制5mol/L
l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三高考前模拟理综化学试卷(解析版) 题型:选择题
《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”据此推测,“青矾”的主要成分为( )
A.CuSO4•5H2O
B.FeSO4•7H2O
C.KAl(SO4)2•12H2O
D.Fe2(SO4)3•9H2O
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是
实验内容 | 实验目的 | |
A | 向1 mL0.1mol/L NaOH溶液中加入2 mL0.1mol/L CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热未出现红色沉淀 | 证明葡萄糖中含有醛基 |
B | 向1 mL0.1mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下, Ksp[Mg(OH)2]>Ksp[Fe(OH3)] |
C | 测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH,前者大于后者 | 证明碳元素非金属性弱于硫 |
D | 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口试纸不变蓝 | 证明溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
锌锰干电池放电时总反应方程式为:Zn(s)+2MnO2+2NH4+ Zn2++Mn2O3(s)+2NH3↑+H2O, 此电池放电时正极(碳棒)上发生反应的物质是
Zn2++Mn2O3(s)+2NH3↑+H2O, 此电池放电时正极(碳棒)上发生反应的物质是
A.Zn B.碳 C.MnO2和NH4+ D.Zn2+和NH3
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:实验题
实验室用下图所示装置制备AlC13溶液,并用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO·7Al2O3)。已知A1C13易水解,易升华。
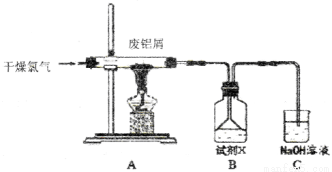
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为____________;
②C装置的作用____________;
(2)氯气与废铝屑反应生成的AlC13蒸气溶解在B中,B中盛放的试剂X是____________;为了防止AlC13蒸气凝华堵塞导管,实验中可采取的措施是____________(写出一点)。
(3)B装置中的AlC13溶液溶解CaCO3时,AlC13溶液和碳酸钙粉末的混合方式为____________;
(4)实验要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是____________;
(5)以工业碳酸钙(含有少量A12O3、Fe2O3杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,____________。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)

(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟三理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列有关说法正确的是
A.1L1mol/L的甲醇水溶液中含有氢原子总数为4NA
B.50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
C.反应KIO3+6HI=KI+3H2O+3I2中,生成3molI2转移电子的总数为5NA
D.12g石墨和C60的混合物中质子总数为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com