
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
分析 (1)酸碱的物质的量相等,如为强碱,反应后溶液呈中性,如为弱碱,反应后溶液呈碱性;
(2)从溶液电中性的角度分析;
(3)物质的量浓度为0.2mol•L-1,的XOH与物质的量浓度为0.1mol•L-1,的HCl反应后溶液呈酸性,由于HCl为强酸,则XOH为弱碱,根据溶液显酸性并结合X+是弱碱阳离子会发生水解来对离子浓度进行排序;
(4)等物质的量的XOH和HCl完全反应,溶液呈酸性是由X+水解导致的,而且溶液中氢氧根离子和氢离子全部来自于水的电离,而且由水电离出的c(OH-)=c(H+),依据溶液中电荷守恒和物料守恒计算写出.
解答 解:(1)一元碱XOH和HCl溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则XOH是强碱,如a<7,反应后呈酸性,则XOH是弱碱,
故答案为:a=7为强碱,a<7为弱碱;
(2)反应后溶液呈中性,如XOH为强碱,则c=0.2,如XOH为弱碱,则c>0.2,仅从乙组情况分析,c不一定等于0.2,由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(X+)+c(H+)=c(Cl-)+c(OH-),所以c(Cl-)=c(X+),
故答案为:否;c(Cl-)=c(X+);
(3)物质的量浓度为0.2mol•L-1,的XOH与物质的量浓度为0.1mol•L-1,的HCl反应后溶液呈酸性,由于HCl为强酸,则XOH为弱碱;X+是弱碱阳离子会发生水解,在溶液中存在X++H2O?XOH+H+,则c(Cl-)>c(X+),由于溶液呈酸性,则c(H+)>c(OH-),一般来说,盐类的水解程度较低,则有c(X+)>c(H+),所以有:c(Cl-)>c(X+)>c(H+)>c(OH-),
故答案为:弱;(Cl-)>c(X+)>c(H+)>c(OH-);
(4)溶液的pH=5,则氢离子浓度为10-5 mol/L,c(OH-)=10-9mol/L,溶液中氢氧根离子和氢离子全部来自于水的电离,OH-是被X+结合后剩下的,故H+的浓度才是H2O电离出的全部,根据水电离出的c(OH-)=c(H+),故水电离出的c(OH-)=c(H+)=10-5 mol/L,
一元酸HCl和XOH溶液等体积混合生成XCl溶液,溶液中存在电荷守恒:c(X+)+c(H+)=c(Cl-)+c(OH-),
依据上述计算得到:c(Cl-)-c(X+)=c(H+)-c(OH-)=10-5-10-9;
依据溶液中电荷守恒和物料守恒得到:c(X+)+c(H+)=c(Cl-)+c(OH-),c(Cl-)=c(X+)+c(XOH),合并得到c(H+)-c(XOH)=c(OH-)=10-9 mol/L
故答案为:10-5-10-9;10-9.
点评 本题考查了物质性质的实验验证方法和判断,主要是强电解质弱电解质的判断方法,溶液中的电荷守恒、物料守恒是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 太阳能、氢能、风能、生物质能都属于新能源 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 镀层破损后,马口铁比白铁更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
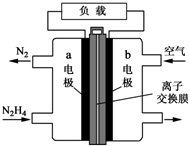 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com