

| A、装置I,铜片上有O2逸出 |
| B、装置I,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+═Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从锌电极流向铜电极 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B、Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C、X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D、Z的氢化物比X的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| AlCl3 |
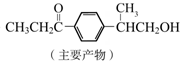 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
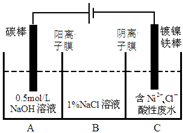 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ |
| C、①③④ | D、都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铜溶液显酸性:Cu2++2H2O?Cu(OH)2+2H+ |
| B、氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2Cl-+I2 |
| C、向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-?Al(OH)3↓ |
| D、实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2OH-?SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 解释或结论 | |||||
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 | ||||
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3晶体 | ||||
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | Al3++3H2O
| ||||
| D | 将Na放入CuSO4溶液中 | 有红色固体析出 | 2Na+Cu2+═Cu+2Na+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛.| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com